چشمانداز بالینی و پاتوبیولوژیک آدنوکارسینوم مجرایی پانکراس
پیشرفت خاموش، مقاومت استرومایی و اختلالات متابولیک سیستمیک
خلاصه اجرایی
آدنوکارسینوم مجرایی پانکراس (PDAC) همچنان یکی از چالشبرانگیزترین معماهای انکولوژی مدرن است که با پارادوکسی از تهاجم بیولوژیکی پنهان در پشت یک دوره نهفتگی بالینی طولانی و خاموش مشخص میشود. این گزارش یک تحلیل جامع و دقیق از رفتار بالینی بیماری ارائه میدهد و فراتر از اپیدمیولوژی پایه حرکت میکند تا مکانیسمهای سلولی و مولکولی را که منجر به کشندگی بالای آن میشوند، بررسی نماید. ما پایههای آناتومیک و ژنتیکی پیشرفت “خاموش” آن، سد غیرقابل نفوذی که توسط ریزمحیط دسموپلاستیک (desmoplastic stroma) ایجاد میشود، و رابطه پیچیده و دوطرفه بین بدخیمی و اختلالات متابولیک، به ویژه دیابت با شروع جدید (New-Onset Diabetes – NOD) را مورد بررسی قرار میدهیم. علاوه بر این، این گزارش تأثیرات مکانیکی عوامل خطر قابل تغییر مانند سیگار کشیدن و چاقی مرکزی (central adiposity) را تشریح کرده و محدودیتهای فعلی رادیولوژیک و بیوشیمیایی را که مانع تشخیص زودهنگام میشوند، ارزیابی میکند.
۱. آناتومی سکوت: پاتوفیزیولوژی پیشرفت پنهان
توصیف سرطان پانکراس به عنوان “قاتل خاموش” (Silent Killer) صرفاً اشارهای به فقدان درد در مراحل اولیه نیست، بلکه بازتابی از تعامل پیچیده بین موقعیت آناتومیک اندام و بیولوژی تکاملی تومور است. اگرچه تظاهرات بالینی اغلب ناگهانی و فاجعهبار است، مطالعات توالییابی ژنتیکی نشان میدهند که تومور اولیه طی سالها—و احتمالاً یک دهه یا بیشتر—قبل از تشخیص بالینی تکامل مییابد.
۱.۱ انزوای رتروپریتونئال و تأخیر در بروز علائم
محرک اصلی پیشرفت خاموش، موقعیت آناتومیک لوزالمعده است. این اندام که در عمق فضای رتروپریتونئال قرار گرفته، فاقد کپسول حسی مشخصی است که در سایر ارگانها مانند کبد یا کلیه وجود دارد و در صورت اتساع باعث ایجاد درد میشود. در نتیجه، یک تومور میتواند بدون اینکه فشاری بر اعصاب سوماتیک وارد کند، به طور قابل توجهی گسترش یابد.
علائمی مانند زردی بدون درد (Painless Jaundice) تنها زمانی رخ میدهند که تومورها در سر پانکراس و در مجاورت فوری مجرای صفراوی مشترک ایجاد شوند. با این حال، تومورهایی که در تنه یا دم پانکراس ایجاد میشوند، میتوانند بدون مانع رشد کنند. زمانی که درد پشت ظاهر میشود—که اغلب به عنوان یک احساس مبهم و احشایی توصیف میشود—اغلب نشاندهنده آن است که تومور از مرزهای پانکراس عبور کرده و به شبکه عصبی سلیاک تهاجم کرده است.
۱.۲ جدول زمانی ژنتیکی کارسینوژنز
برخلاف تصور رایج، PDAC حاصل تجمع آهسته و گامبهگام آسیبهای ژنتیکی است:
- شروع (KRAS): فعالسازی انکوژن KRAS رویداد بنیادین است که در بیش از ۹۰٪ موارد وجود دارد.
- پیشرفت (از دست دادن سرکوبگر تومور): انتقال از PanIN با درجه پایین به دیسپلازی با درجه بالا شامل غیرفعالسازی بعدی ژنهای CDKN2A (p16)، TP53 و SMAD4 است.
تخمین زده میشود که بین جهش آغازگر و ایجاد یک کلون متاستاتیک، ممکن است ۱۰ تا ۱۵ سال فاصله باشد. تراژدی PDAC در این است که این فاز طولانی پیشتهاجمی برای فناوریهای تشخیصی فعلی نامرئی باقی میماند.
۱.۳ انتظار پاتوبیولوژیک رشد
از دیدگاه پاتوبیولوژی، PDAC یک تومور “اسکیروس” (scirrhous) یا به شدت فیبروتیک است. استرومای متراکم به عنوان یک محدودیت فیزیکی عمل میکند و انبساط حجمی توده تومور اپیتلیال را محدود میسازد. بنابراین، سکوت PDAC تا حدی تابعی از سفتی ساختاری خود آن است که رشد حجمی را پنهان میکند.
۲. قلعه استرومایی: مکانیسمهای مقاومت درمانی و دسموپلازی
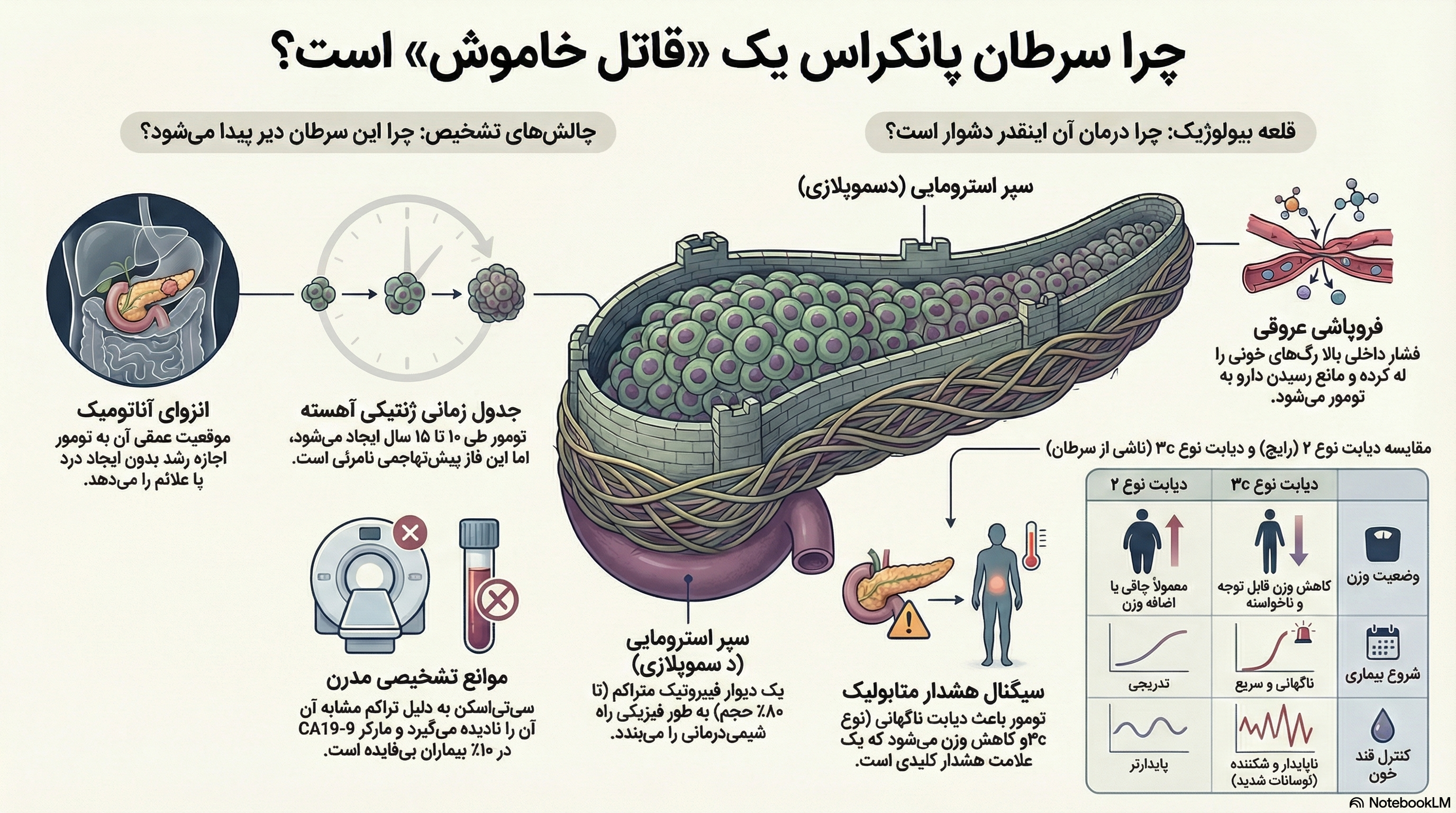
یکی از ویژگیهای بارز PDAC، واکنش دسموپلاستیک است—یک استرومای فیبروتیک و متراکم که میتواند تا ۸۰٪ حجم تومور را تشکیل دهد. استروما معمار اصلی “قلعهای” است که PDAC را در برابر شیمیدرمانی سیستمیک مقاوم میسازد.
۲.۱ اجزای سلولی: سلول ستارهای پانکراس (PSC)
هماهنگکننده مرکزی دسموپلازی، سلول ستارهای پانکراس (PSC) است. در پانکراس سالم، PSCها سلولهای خفته هستند. به محض تغییر نئوپلاستیک سلولهای مجرایی، PSCها فعال شده و به سلولهای شبهمیوفیبروبلاست تغییر ماهیت میدهند و مقادیر عظیمی از پروتئینهای ماتریکس خارج سلولی (کلاژن) را سنتز میکنند. این همکاری شوم بین سلولهای تومورال و استرومایی، محیطی را ایجاد میکند که نه تنها از تومور محافظت میکند، بلکه تهاجم آن را نیز تسهیل مینماید.
۲.۲ بیوفیزیک مقاومت: هیالورونان و فشار مایع بینبافتی
هیالورونان (HA) یک پلیمر هیدروفیل عظیم است که ظرفیت خارقالعادهای برای اتصال به آب دارد. در فضای محدود تومور، تجمع HA باعث افزایش شدید فشار هیدرواستاتیک میشود. نتیجه، فشار مایع بینبافتی (IFP) بسیار بالا است که منجر به پیامدهای زیر میشود:
- کلاپس عروقی: فشار وارده باعث روی هم خوابیدن مویرگها و ایجاد توموری کمعروق و هیپوکسیک میشود.
- سد پرفیوژن: شیمیدرمانی سیستمیک نمیتواند به بستر تومور برسد.
- سد انتشار: ماتریکس متراکم مانع از انتشار دارو به سلولهای نئوپلاستیک میشود.
۲.۳ بحث SPARC و تحویل متصل به آلبومین
پروتئین SPARC یک پروتئین ماتریکس سلولی متصلشونده به آلبومین است. فرضیه این بود که داروی nab-paclitaxel میتواند از SPARC برای نفوذ به تومور استفاده کند. با این حال، مطالعات بالینی نتایج متناقضی نشان دادهاند و پیچیدگی استروما را برجسته کردهاند: استروما یک هدف یکنواخت نیست و استراتژیهای سادهانگارانهی “تخلیه استروما” گاهی میتوانند تهاجم تومور را تسریع کنند.
۳. سیگنال متابولیک: دیابت به عنوان سندرم پارانئوپلاستیک
رابطه بین دیابت و سرطان پانکراس دوطرفه است. دیابت با شروع جدید (New-Onset Diabetes – NOD) به عنوان یک سیگنال هشداردهنده منحصر به فرد و زودهنگام عمل میکند.
۳.۱ تمایز دیابت نوع ۳c از دیابت نوع ۲
تشخیص دیابت مرتبط با PDAC (نوع ۳c) از دیابت نوع ۲ رایج، چالش اصلی است:
- پروفایل زمانی: خطر ابتلا به PDAC در ۱ تا ۳ سال اول پس از تشخیص دیابت در بالاترین حد خود قرار دارد.
- پارادوکس کاهش وزن: برخلاف دیابت نوع ۲ که با چاقی همراه است، دیابت نوع ۳c با کاهش وزن ناگهانی و غیرقابل توجیه همراه است.
- ناپایداری متابولیک: دیابت نوع ۳c اغلب “شکننده” است و با نوسانات شدید قند خون همراه میباشد.
| ویژگی بالینی | دیابت نوع ۲ (T2DM) | دیابت نوع ۳c (پانکراتوژنیک) |
|---|---|---|
| وضعیت وزن | معمولاً چاقی | کاهش وزن قابل توجه |
| شروع بیماری | تدریجی | ناگهانی و سریع |
| سابقه خانوادگی | شایع و قوی | کمتر مرتبط |
| مقاومت به انسولین | بالا | همراه با اختلال عملکرد شدید سلول بتا |
| کنترل قند خون | پایدارتر | ناپایدار (Brittle) |
| سطح پپتید C | نرمال یا بالا | پایین |
۳.۲ مکانیسمهای اختلال عملکرد سلول بتا پارانئوپلاستیک
دیابت در مراحل اولیه PDAC صرفاً نتیجه تخریب مکانیکی نیست، بلکه ناشی از واسطههای هومورال ترشح شده توسط تومور است.
آدرنومدولین اگزوزومال: سلولهای PDAC اگزوزومهای حاوی آدرنومدولین (AM) را رها میکنند. AM به سلولهای بتا متصل شده و ترشح انسولین را مهار میکند. همچنین، این اگزوزومها لیپولیز (تحلیل چربی) را در بافت چربی القا میکنند که کاهش وزن مشخص بیماران را توضیح میدهد.
۴. شتابدهندههای بدخیمی: خطرات اتیولوژیک خاص
عوامل محیطی مانند سیگار کشیدن و چاقی مرکزی به عنوان شتابدهندههای قدرتمند عمل میکنند.
۴.۱ سیگار کشیدن: تعدیلکننده عصبی-شیمیایی
سیگار کشیدن خطر ابتلا به PDAC را دو برابر میکند. ماده NNK موجود در تنباکو نه تنها جهشهای KRAS را القا میکند، بلکه با اتصال به گیرندههای سلولی، مسیرهای تکثیر سلولی را فعال کرده و ویژگیهای “شبه سلول بنیادی” را ترویج میکند.
۴.۲ چاقی مرکزی: التهاب احشایی
چاقی مرکزی (شکمی) پیشبینیکننده قویتری نسبت به BMI است. چربی احشایی با ترشح لپتین (پیشالتهابی) و کاهش آدیپونکتین، محیطی مناسب برای رشد تومور ایجاد میکند. همچنین، مقاومت به انسولین و سطوح بالای IGF-1، بقای سلولهای سرطانی را تقویت میکنند.
۵. خلاء تشخیصی: چالشها در تشخیص زودهنگام
تشخیص زودهنگام همچنان پاشنه آشیل انکولوژی پانکراس است.
۵.۱ پدیده همتراکمی (Isoattenuation)
درصد قابل توجهی از تومورهای PDAC در سیتی اسکن “همتراکم” هستند، یعنی تراکم آنها با بافت طبیعی پانکراس یکسان است و نامرئی به نظر میرسند. رادیولوژیستها باید به علائم ثانویه مانند “مجرای قطع شده” یا آتروفی پارانشیم تکیه کنند. MRI حساستر است اما برای غربالگری گران است.
۵.۲ بنبست بیومارکر: CA19-9 و آنتیژن لوئیس
CA19-9 تنها بیومارکر تأیید شده است، اما ناقص است. حدود ۵-۱۰٪ جمعیت (ژنوتیپ لوئیس منفی) فاقد آنزیم لازم برای تولید CA19-9 هستند و حتی با تومورهای بزرگ، سطح مارکر در آنها نرمال میماند. همچنین، این مارکر در شرایط خوشخیم نیز افزایش مییابد (مثبت کاذب بالا).
۶. تعاملات عصبی-ایمنی و مکانیسم درد
درد در PDAC تظاهری از “نوروتروپیسم” است. سلولهای سرطانی فاکتورهای نوروتروفیک ترشح میکنند که رشد اعصاب را جذب میکند (تهاجم دور عصبی). اعصاب درگیر شده دچار آسیب ساختاری میشوند که منجر به درد نوروپاتیک شدید میگردد. حضور این تهاجم، پیشبینیکننده بقای ضعیف است.
۷. نتیجهگیری و چشمانداز آینده
کشندگی سرطان پانکراس محصول یک طوفان بیولوژیک کامل است. “سکوت” بیماری یک نامگذاری غلط است؛ سیگنالهایی مانند دیابت با شروع جدید وجود دارند که باید جدی گرفته شوند.
درمانهای آینده باید بر “نرمالسازی استروما” (به جای حذف آن) و هدف قرار دادن سیستمهای پشتیبانی متابولیک و عصبی تومور متمرکز شوند. غربالگری هدفمند در بیماران با دیابت جدید و سن بالا، ملموسترین فرصت برای تغییر مسیر تشخیص است.
| جزء مانع | مکانیسم بیولوژیکی | پیامد بالینی |
|---|---|---|
| هیالورونان (HA) | احتباس آب، فشار بالای IFP | کلاپس عروقی؛ عدم نفوذ شیمیدرمانی. |
| دسموپلازی | سد فیزیکی متراکم | ایجاد “همتراکمی” در CT. |
| هیپوواسکولاریته | فشردگی عروق | مقاومت به رادیوتراپی. |
| تهاجم دور عصبی | استفاده از غلاف عصبی به عنوان مسیر | درد شدید؛ انتشار تومور. |
| ژنوتیپ لوئیس منفی | ناتوانی در تولید CA19-9 | نتایج منفی کاذب بیومارکر. |
| اگزوزومهای پارانئوپلاستیک | ترشح آدرنومدولین | دیابت نوع 3c قبل از تشخیص توده. |
بازبینی توسط متخصص
بازبین علمی این مقاله
آیا نگران سابقه خانوادگی سرطان پانکراس هستید؟
اگر سابقه سرطان پانکراس یا دیابت ناگهانی در خانواده دارید، درک ریسک ژنتیکی میتواند حیاتی باشد. تیم ما آماده ارائه مشاوره تخصصی برای ارزیابی خطر و غربالگری است.
دریافت مشاوره ژنتیک