تست ژنتیک پلاویکس (کلوپیدوگرل)؛ آیا این دارو واقعاً برای بدن شما مناسب است؟
تحلیل جامع فارماکوژنتیک، مقاومت دارویی و انتخاب درمان بهینه
چکیده اجرایی
بیماریهای قلبی-عروقی، به ویژه بیماریهای عروق کرونر (CAD)، همچنان عامل اصلی مرگومیر در سطح جهان محسوب میشوند. در مدیریت این بیماریها، بهویژه پس از سندرمهای حاد کرونری (ACS) و مداخلات کرونری از طریق پوست (PCI)، درمان ضدپلاکت دوگانه (DAPT) که سنگ بنای آن کلوپیدوگرل (پلاویکس) است، نقشی حیاتی ایفا میکند. با این حال، کلوپیدوگرل یک داروی “یک سایز برای همه” نیست. این گزارش جامع تحقیقاتی، با بررسی دقیق متون علمی، کارآزماییهای بالینی بزرگ و دستورالعملهای بینالمللی، به تحلیل عمیق فارماکوژنتیک کلوپیدوگرل میپردازد.
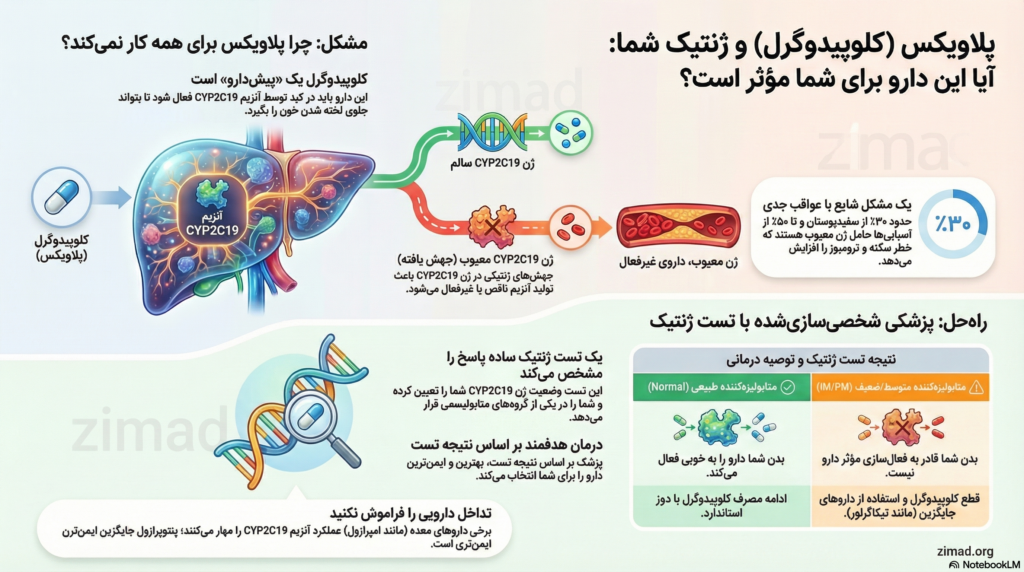
یافتههای این گزارش نشان میدهد که اثربخشی کلوپیدوگرل، به عنوان یک پیشدارو، وابستگی شدیدی به فعالسازی متابولیک توسط آنزیم کبدی CYP2C19 دارد. واریانتهای ژنتیکی “فقدان عملکرد” (Loss-of-Function) در ژن CYP2C19، که در حدود ۳۰ درصد از جمعیت سفیدپوستان و تا ۵۰ درصد از جمعیتهای آسیایی شایع است، منجر به عدم توانایی در تبدیل دارو به فرم فعال آن میشود. این نارسایی متابولیک بیماران را در معرض خطر بالای شکست درمانی، ترومبوز استنت، انفارکتوس مجدد میوکارد و مرگ قلبی-عروقی قرار میدهد. در مقابل، استراتژیهای درمانی هدایتشده با ژنوتیپ، که در آن بیماران دارای اختلال ژنتیکی به داروهای قویتر (مانند تیکاگرلور یا پراسوگرل) و بیماران دارای ژنتیک نرمال به کلوپیدوگرل اختصاص داده میشوند، نه تنها از نظر کاهش حوادث ایسکمیک مؤثرتر هستند، بلکه با کاهش خطر خونریزی در جمعیت نرمال، ایمنی بالاتری را نیز ارائه میدهند. این گزارش نتیجه میگیرد که پزشکی دقیق (Precision Medicine) و انجام تست ژنتیک CYP2C19 قبل از تجویز کلوپیدوگرل، به ویژه در بیماران پرخطر و تحت PCI، یک ضرورت بالینی برای بهینهسازی نتایج درمان و کاهش مرگومیر است.
۱. مقدمه: تغییر پارادایم در درمانهای ضدپلاکت
تاریخچه درمانهای قلبی-عروقی همواره با تلاش برای غلبه بر تشکیل لختههای ناخواسته (ترومبوز) در عروق حیاتی همراه بوده است. پلاکتها، به عنوان سربازان خط مقدم سیستم انعقادی، نقش دوگانهای در فیزیولوژی بدن دارند: از یک سو با تشکیل میخ پلاکتی از خونریزیهای مرگبار جلوگیری میکنند و از سوی دیگر، فعالسازی نابجای آنها بر روی پلاکهای آترواسکلروتیک پاره شده، منجر به انسداد عروق و حوادثی نظیر سکته قلبی و مغزی میشود. ظهور داروهای مهارکننده گیرنده P2Y12، و در رأس آنها کلوپیدوگرل، انقلابی در پیشگیری ثانویه از این حوادث ایجاد کرد.
با این حال، با پیشرفت علم فارماکوژنتیک و مشاهده بالینی بیمارانی که با وجود مصرف منظم دارو دچار عود بیماری میشدند، این سوال مطرح شد: چرا کلوپیدوگرل در برخی بیماران معجزه میکند و در برخی دیگر کاملاً بیاثر است؟ پاسخ این سوال در تفاوتهای بنیادین بیولوژیکی و ژنتیکی افراد نهفته است. مفهوم “مقاومت به کلوپیدوگرل” یا دقیقتر بگوییم، “واکنشپذیری بالای پلاکتی حین درمان” (HTPR)، نشاندهنده شکست دارو در مهار کافی فعالیت پلاکتهاست. این پدیده صرفاً یک یافته آزمایشگاهی نیست؛ بلکه مستقیماً با افزایش مرگومیر و حوادث ناگوار بالینی مرتبط است.
۲. فارماکودینامیک و فارماکوکینتیک: مکانیسم اثر و مسیر متابولیک
برای درک اینکه چرا تست ژنتیک اهمیت دارد، ابتدا باید پیچیدگیهای فارماکولوژیک کلوپیدوگرل را بررسی کنیم. برخلاف بسیاری از داروها که پس از جذب مستقیماً اثر میکنند، کلوپیدوگرل یک “پیشدارو” (Prodrug) است. این بدان معناست که قرصی که بیمار میبلعد، به خودی خود هیچ اثر ضدپلاکتی ندارد و باید طی یک فرآیند زیستی پیچیده در کبد فعال شود.
۲.۱. جذب و انتقال
پس از مصرف خوراکی، کلوپیدوگرل به سرعت از روده جذب میشود. در این مرحله، پروتئین ناقل P-glycoprotein (که توسط ژن ABCB1 کد میشود) نقش مهمی در میزان جذب روده ای دارو دارد.
۲.۲. مسیر متابولیک دو مرحلهای: گلوگاه حیاتی
پس از جذب، کلوپیدوگرل با یک دوراهی متابولیک مواجه میشود که سرنوشت درمانی آن را تعیین میکند:
- مسیر غیرفعالسازی (مسیر غالب): حدود ۸۵٪ از داروی جذب شده توسط آنزیمهای استراز هیدرولیز شده و به مشتقات غیرفعال تبدیل میشوند. این بخش از دارو هیچ خاصیت ضدپلاکتی ندارد.
- مسیر فعالسازی (مسیر کبدی): تنها ۱۵٪ باقیمانده از دارو وارد سیستم سیتوکروم P450 کبدی میشود تا طی دو مرحله اکسیداسیون متوالی فعال شود:
- مرحله اول: تبدیل به متابولیت واسطه توسط آنزیمهای CYP2C19، CYP1A2 و CYP2B6.
- مرحله دوم: تبدیل متابولیت واسطه به متابولیت فعال تیول توسط CYP2C19 و سایر آنزیمها.
همانطور که مشاهده میشود، آنزیم CYP2C19 در هر دو مرحله فعالسازی نقش کلیدی و محوری دارد. این آنزیم گلوگاه اصلی تولید متابولیت فعال است. هرگونه اختلال در عملکرد یا بیان این آنزیم، مستقیماً منجر به کاهش تولید متابولیت فعال و در نتیجه عدم مهار پلاکتها میشود.
۲.۳. مکانیسم اثر بر روی پلاکت
متابولیت فعال کلوپیدوگرل با یک پیوند غیرقابل برگشت به گیرنده P2Y12 روی سطح پلاکت متصل میشود و مانع از اتصال ADP و فعالسازی پلاکت میگردد. چون این مهار غیرقابل برگشت است، پلاکتهای تحت تأثیر تا پایان عمر خود (۷ تا ۱۰ روز) غیرفعال باقی میمانند.
۳. چشمانداز ژنتیک: تنوع پذیری CYP2C19 و پیامدهای آن
ژن CYP2C19 واقع در کروموزوم ۱۰، یکی از پلیمورفیکترین ژنها در سیستم متابولیسم دارویی انسان است. تنوع در توالی DNA این ژن منجر به تولید آنزیمهایی با سطوح فعالیت متفاوت میشود.
۳.۱. تعاریف آللها (Allele Definitions)
- آلل نرمال (CYP2C19*1): کدکننده آنزیم با عملکرد کاملاً طبیعی.
- آللهای فقدان عملکرد (LOF):
- CYP2C19*2: شایعترین واریانت منجر به نقص آنزیمی (جهش نقطهای در اگزون ۵). مسئول اکثریت موارد شکست درمانی.
- CYP2C19*3: دارای کدون توقف زودرس، شایع در جمعیتهای آسیایی.
- آللهای افزایش عملکرد (GOF):
- CYP2C19*17: باعث افزایش رونویسی ژن و متابولیسم فوقسریع دارو میشود.
۳.۲. تنوع نژادی و جغرافیایی (Population Genetics)
تفاوت فاحش در شیوع آللهای LOF در نژادهای مختلف نشان میدهد که استراتژیهای درمانی باید با توجه به بستر نژادی بیمار تنظیم شوند.
| جمعیت / نژاد | شیوع متابولیزهکنندههای ضعیف | توضیحات |
|---|---|---|
| سفیدپوستان | حدود ۲٪ تا ۵٪ | حاملین حداقل یک آلل LOF حدود ۳۰٪ هستند. |
| سیاهپوستان | حدود ۴٪ تا ۵٪ | شیوع آللهای کمتر شناخته شده ممکن است متفاوت باشد. |
| آسیاییها | ۱۴٪ تا ۲۰٪ | بیش از ۵۰٪ جمعیت آسیایی حداقل یک آلل LOF دارند. |
| اهالی اقیانوسیه | تا ۵۷٪ | بالاترین نرخ متابولیزهکننده ضعیف در جهان. |
بینش تحلیلی: شیوع بالای فنوتیپ PM در جمعیتهای آسیایی (بیش از ۱۴٪)، زنگ خطری جدی برای سیستمهای سلامت در آسیاست تا غربالگری ژنتیکی را با جدیت بیشتری دنبال کنند.
۳.۳. فنوتیپهای متابولیک و پیامدهای بالینی
بر اساس ترکیب دو آلل (دیپلوتیپ)، بیماران در پنج گروه طبقهبندی میشوند:
- متابولیزهکننده بسیار سریع (UM): (*17/*17) – فعالیت آنزیمی بالا، خطر خونریزی احتمالی.
- متابولیزهکننده سریع (RM): (*1/*17) – پاسخ درمانی مطلوب.
- متابولیزهکننده نرمال (NM): (*1/*1) – کلوپیدوگرل استاندارد مؤثر است.
- متابولیزهکننده متوسط (IM): (*1/*2, *1/*3) – سطح داروی فعال کاهش یافته، خطر حوادث ایسکمیک بالاتر. کاندیدای تغییر دارو.
- متابولیزهکننده ضعیف (PM): (*2/*2, *2/*3) – فعالیت آنزیمی ناچیز. شکست درمانی قطعی. خطر بالای ترومبوز استنت.
۴. شواهد بالینی: جنگ کارآزماییها
درک جایگاه فعلی تست ژنتیک نیازمند بررسی دقیق سیر تکاملی شواهد بالینی است.
۴.۱. مطالعه TRITON-TIMI 38 (زیرگروه ژنتیکی)
یافتهها: حاملین آللهای LOF که کلوپیدوگرل دریافت کردند، ۵۳ درصد افزایش خطر حوادث قلبی و ۳ برابر خطر ترومبوز استنت داشتند.
نتیجهگیری: برتری پراسوگرل نسبت به کلوپیدوگرل عمدتاً در بیماران با ژنتیک معیوب دیده میشود.
۴.۲. مطالعه POPular Genetics (نقطه عطف ۲۰۱۹)
این مطالعه برای پاسخ به این سوال طراحی شد: آیا میتوانیم فقط به کسانی که ژن معیوب دارند داروی قوی بدهیم؟
نتایج: استراتژی هدایتشده با ژنوتیپ (کلوپیدوگرل برای نرمالها، تیکاگرلور/پراسوگرل برای LOFها) از نظر پیشگیری از حوادث برابر با درمان استاندارد بود، اما منجر به کاهش معنادار خونریزی شد.
پیام کلیدی: غربالگری ژنتیکی نه تنها ایمن است، بلکه با کاهش خونریزی در افراد نرمال، نتایج بالینی را بهبود میبخشد.
۴.۳. مطالعه TAILOR-PCI
نتایج: در ۳ ماه اول درمان (دوره پرخطر)، درمان هدایتشده با ژنوتیپ منجر به کاهش ۷۹ درصدی در ریسک حوادث شد. این یافته اهمیت اثر ژنتیک در ماههای اول پس از PCI را نشان میدهد.
۵. تداخلات دارویی: معضل مهارکنندههای پمپ پروتون (PPI)
بسیاری از بیماران قلبی داروهای معده (PPI) مصرف میکنند که میتواند اثربخشی کلوپیدوگرل را خنثی کند.
۵.۱. مکانیسم تداخل
داروهای PPI و کلوپیدوگرل بر سر آنزیم CYP2C19 رقابت میکنند. PPIهای قوی آنزیم را اشغال کرده و مانع فعالسازی کلوپیدوگرل میشوند.
۵.۲. امپرازول و اسامپرازول: خط قرمز
امپرازول و اسامپرازول قویترین مهارکنندههای CYP2C19 هستند و میتوانند اثر پلاویکس را تا ۵۰ درصد کاهش دهند.
۵.۳. پانتوپرازول و رابپرازول: جایگزینهای ایمن
پانتوپرازول و رابپرازول تأثیر ناچیزی بر CYP2C19 دارند و تداخل معناداری با کلوپیدوگرل ایجاد نمیکنند. توصیه بالینی: در مصرفکنندگان کلوپیدوگرل، پانتوپرازول گزینه ارجح است.
۶. تکامل دستورالعملهای قانونی و نظارتی
۶.۱. سازمان غذا و داروی آمریکا (FDA)
در سال ۲۰۱۰، FDA “هشدار جعبه سیاه” را صادر کرد و اعلام نمود کلوپیدوگرل در متابولیزهکنندههای ضعیف اثربخشی کمتری دارد و پزشکان باید از استراتژیهای جایگزین استفاده کنند.
۶.۲. کنسرسیوم CPIC (نسخه ۲۰۲۲)
توصیههای CPIC بسیار صریح هستند:
- متابولیزهکننده ضعیف (PM): منع مصرف کلوپیدوگرل. تجویز تیکاگرلور یا پراسوگرل (توصیه قوی).
- متابولیزهکننده متوسط (IM): منع مصرف کلوپیدوگرل. تجویز تیکاگرلور یا پراسوگرل (توصیه قوی).
- متابولیزهکننده نرمال: مصرف کلوپیدوگرل با دوز استاندارد.
۷. فارماکواکونومیکس و هزینه-اثربخشی
استراتژی “تست ژنتیک همگانی + درمان هدفمند” از نظر هزینه-اثربخشی بسیار مطلوب است. شناسایی ۳۰٪ پرخطر و درمان آنها با داروی گران، و درمان ۷۰٪ باقیمانده با داروی ارزان، تعادل بهینهای بین هزینه و فایده ایجاد میکند و از هزینههای سنگین درمان عوارض (سکته یا خونریزی) میکاهد.
۸. پیادهسازی بالینی و مدیریت بیمار
۸.۱. چه کسانی باید تست شوند؟
- بیماران تحت PCI با ریسک بالا (استنتگذاری پیچیده).
- سابقه ترومبوز حین مصرف کلوپیدوگرل.
- بیماران آسیاییتبار.
- بیماران با ریسک خونریزی بالا (برای اطمینان از ایمنی کلوپیدوگرل).
۸.۲. سوالاتی که بیمار باید بپرسد
“دکتر، آیا ژنتیک من اجازه میدهد که بدنم پلاویکس را فعال کند؟”
“من داروی معده مصرف میکنم. آیا با پلاویکس تداخل دارد؟”
“اگر من متابولیزهکننده ضعیف باشم، چه جایگزینی دارم؟”
۸.۳. تفسیر نتایج برای بیمار
نتیجه 1/1: ژن نرمال. کلوپیدوگرل عالی کار میکند.
نتیجه *2/*2 یا *2/*3: بدن شما دارو را فعال نمیکند. باید فوراً دارو به تیکاگرلور یا پراسوگرل تغییر یابد.
۹. مسیر آینده و نتیجهگیری
شواهد علمی کنونی جای تردیدی باقی نمیگذارند که پاسخ به کلوپیدوگرل یک ویژگی ژنتیکی است. تست ژنتیک CYP2C19 دیگر یک ابزار لوکس نیست، بلکه یک ضرورت بالینی برای تصمیمگیری آگاهانه است.
آیا کلوپیدوگرل برای بدن شما مناسب است؟ پاسخ بستگی به DNA شما دارد. اگر ژنوتیپ نرمال دارید، ایمن و مؤثر است. اما اگر ژنوتیپ معیوب دارید، مصرف آن میتواند خطرناک باشد. با انجام تست ژنتیک و مدیریت تداخلات دارویی، میتوانیم قدرت واقعی این دارو را برای پاسخدهندگان حفظ کنیم و دیگران را با داروهای جایگزین نجات دهیم.
بازبینی توسط متخصص
بازبین علمی این مقاله
آیا نگران اثربخشی داروی قلب خود هستید؟
اگر تحت آنژیوپلاستی قرار گرفتهاید یا پلاویکس مصرف میکنید، دانستن وضعیت ژنتیکی متابولیسم داروی شما میتواند نجاتبخش باشد. تیم ما آماده ارائه مشاوره تخصصی فارماکوژنتیک است.
دریافت مشاوره ژنتیک