تحلیل جامع پاتوفیزیولوژیک و بالینی انتریت منطقهای (بیماری کرون)
از التهاب ترانسمورال تا عوارض ساختاری و تمایز با کولیت اولسراتیو
مقدمه و تکامل مفهوم انتریت منطقهای
بیماری کرون که در ادبیات کلاسیک پزشکی با نام انتریت منطقهای (Regional Enteritis) شناخته میشود، یکی از پیچیدهترین اختلالات التهابی دستگاه گوارش است که به دلیل ماهیت مزمن، پیشرونده و پتانسیل تخریبی بالا، چالشهای بیشماری را برای سیستمهای بهداشتی و درمانی ایجاد کرده است. این وضعیت که نخستین بار در سال ۱۹۳۲ توسط بوریل کرون و همکارانش به عنوان یک بیماری محدود به ایلئوم ترمینال توصیف شد، اکنون به عنوان یک فنوتیپ گسترده شناخته میشود که قادر است هر نقطهای از مجرای گوارشی را از حفره دهان تا ناحیه پریآنال درگیر سازد. انتریت منطقهای در واقع تظاهری از یک پاسخ ایمنی نامنظم و مداوم است که در افراد واجد شرایط ژنتیکی، تحت تأثیر محرکهای محیطی و تغییرات میکروبیوتای روده برانگیخته میشود.
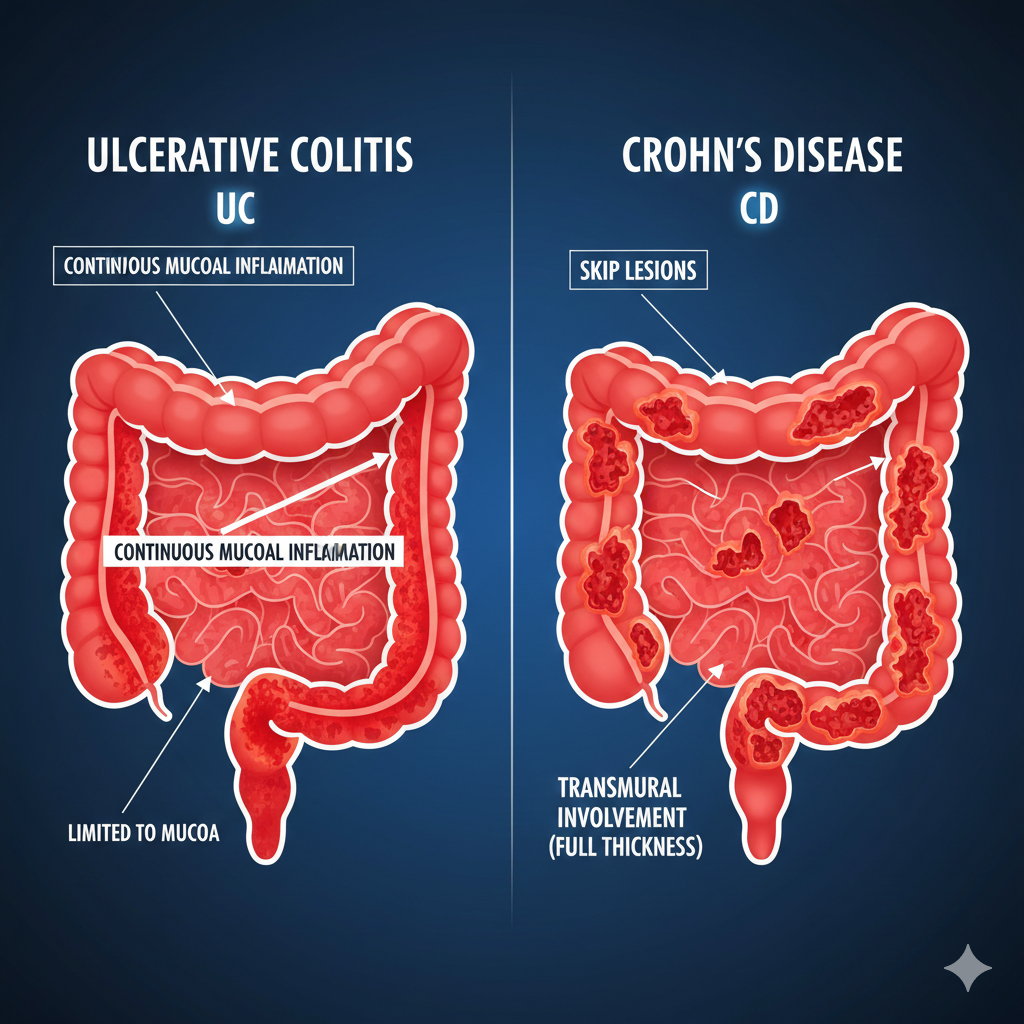
تفاوت بنیادین این بیماری با سایر شکلهای التهاب روده، در الگوی تهاجم بافتی آن نهفته است. در حالی که بسیاری از التهابها سطحی باقی میمانند، انتریت منطقهای با ویژگی “ترانسمورال” (Transmural) یا تمامجداری شناخته میشود؛ به این معنا که التهاب تنها به مخاط محدود نشده و به لایههای عمقیتر شامل زیرمخاط، لایههای عضلانی و در نهایت سروز نفوذ میکند. این عمق نفوذ، منشأ اصلی عوارض ساختاری نظیر فیستولها، تنگیها و آبسهها است که در ادامه این گزارش به تفصیل مورد بحث قرار خواهند گرفت.
پاتوفیزیولوژی و مکانیسمهای مولکولی التهاب تمامجداری
درک ماهیت ترانسمورال بیماری کرون مستلزم بررسی دقیق فعل و انفعالات ایمنی در سطوح سلولی و مولکولی است. فرآیند التهاب با گسست در سد اپیتلیال آغاز میشود که اجازه میدهد آنتیژنهای لومینال و باکتریها به لامینا پروپریا نفوذ کنند. در افراد سالم، سیستم ایمنی مخاطی این نفوذ را با یک پاسخ کنترل شده مدیریت میکند، اما در بیماران مبتلا به کرون، یک پاسخ ایمنی لجامگسیخته با واسطه سلولهای T کمککننده نوع ۱ (Th1) و نوع ۱۷ (Th17) شکل میگیرد.
نقش سیتوکینها و واسطههای التهابی
آبشار التهابی در بیماری کرون با تولید گسترده سیتوکینهای پیشالتهابی نظیر فاکتور نکروز تومور آلفا (TNF-α)، اینترفرون گاما (IFN-γ) و اینترلوکینهای مختلف از جمله IL-12، IL-18 و IL-23 همراه است. این واسطهها نه تنها باعث جذب بیشتر لکوسیتها به محل التهاب میشوند، بلکه با فعالسازی متالوپروتئینازهای ماتریکس (MMPs)، تخریب ساختاری بافت پیوندی را در تمام لایههای دیواره روده تسهیل میکنند. نفوذ این التهاب به لایههای عمقی، منجر به تشکیل تجمعات لنفوئیدی در سروز و چربیهای مزانتریک میشود که پدیدهای موسوم به “چربی خزنده” (Creeping Fat) را ایجاد میکند؛ وضعیتی که در آن بافت چربی اطراف روده ملتهب شده و به سمت دیواره روده گسترش مییابد تا شاید التهاب را محصور کند، اما خود به منبعی برای ترشح آدیپوکینهای پیشالتهابی تبدیل میشود.
گرانولومها و اهمیت بافتشناختی آنها
یکی از شاخصهای پاتولوژیک انتریت منطقهای که در حدود ۳۳ تا ۵۰ درصد بیماران مشاهده میشود، تشکیل گرانولومهای غیرکازئیفیه است. این گرانولومها که از تجمع هیستیوسیتهای اپیتلیوئید و سلولهای غولآسا تشکیل شدهاند، نشاندهنده یک پاسخ مزمن و پایدار به آنتیژنهایی هستند که سیستم ایمنی قادر به پاکسازی کامل آنها نبوده است. حضور این گرانولومها در نمونههای بیوپسی یا جراحی، یک معیار تمایز دهنده قوی بین بیماری کرون و کولیت اولسراتیو محسوب میشود، هرچند عدم وجود آنها تشخیص کرون را رد نمیکند.
| ویژگی پاتولوژیک | بیماری کرون (CD) | کولیت اولسراتیو (UC) |
|---|---|---|
| عمق درگیری | تمامجداری (مخاط تا سروز) | محدود به مخاط و زیرمخاط |
| گرانولوم | حاضر در بسیاری از موارد | غایب (به جز موارد استثنایی) |
| آبسههای کریپت | کمتر شایع و پراکنده | بسیار شایع و مداوم |
| تخلیه موسین | معمولاً خفیف | شدید و مداوم |
| فیبروز | شدید و در تمام لایهها | سطحی و محدود |
آناتومی ضایعات پرشی (Skip Lesions) و گستره دستگاه گوارش
برخلاف کولیت اولسراتیو که همواره از رکتوم آغاز شده و به صورت پیوسته و متقارن به سمت پروگزیمال گسترش مییابد، انتریت منطقهای دارای الگوی درگیری “تکهای” یا “ناپیوسته” است. این پدیده که تحت عنوان ضایعات پرشی (Skip Lesions) شناخته میشود، به معنای وجود نواحی ملتهب و زخمی در کنار بخشهایی از روده است که از نظر ماکروسکوپی و میکروسکوپی کاملاً سالم به نظر میرسند.
پتانسیل درگیری از دهان تا مقعد
اگرچه ایلئوم ترمینال و سکوم شایعترین محلهای درگیری هستند (تقریباً در ۵۰٪ موارد)، اما بیماری کرون میتواند در هر بخشی از مسیر گوارشی ظاهر شود.
- دهان و مری: تظاهرات در دهان میتواند به صورت زخمهای آفتی دردناک یا ادم لبها ظاهر شود. درگیری مری، هرچند نادر است (کمتر از ۱٪)، میتواند منجر به دیسفاژی و تنگیهای مری شود.
- معده و دوازدهه: درگیری گاسترودئودنال در ۵٪ بیماران مشاهده میشود و معمولاً با درد اپیگاستر و علائم انسداد خروجی معده همراه است.
- روده کوچک (ژژونوم و ایلئوم): بیش از ۸۰٪ بیماران دارای درجاتی از درگیری ایلئال هستند. درگیری ژژونال با پیشآگهی بدتر همراه است.
- کولون و رکتوم: در کرون کولیت، رکتوم در حدود ۴۰٪ موارد درگیر نمیشود (Rectal Sparing). همچنین، درگیری اطراف مقعد شامل فیشرها و فیستولها در یکسوم بیماران دیده میشود.
پیامدهای بالینی و جراحی ضایعات پرشی
وجود ضایعات پرشی چالشهای مدیریتی قابل توجهی ایجاد میکند. از منظر تشخیصی، استفاده از تکنیکهای تصویربرداری مقطعی مانند انتروگرافی MRI (MRE) برای ارزیابی کل طول روده ضروری است. از منظر جراحی، وجود این ضایعات به معنای آن است که حذف یک بخش ملتهب لزوماً به معنای پاکسازی بیماری نیست و ریسک عود همواره وجود دارد.
عوارض نفوذی: مکانیسم و تنوع فیستولها
فیستولها (Fistulae) تظاهر نهایی و مخرب التهاب ترانسمورال هستند. هنگامی که التهاب تمام ضخامت دیواره روده را در بر میگیرد، منجر به ایجاد اولسرهای نفوذی عمیق میشود که در نهایت راه خود را به اندامهای مجاور یا سطح پوست باز میکنند. برآورد میشود که بین ۱۷ تا ۵۰ درصد از بیماران کرون در طول زندگی خود دچار فیستول میشوند.
انتقال اپیتلیال به مزانشیمی (EMT) در تشکیل فیستول
تحقیقات نوین نشان داده است که تشکیل فیستول صرفاً یک پدیده مکانیکی ناشی از فشار لومینال نیست، بلکه یک فرآیند بیولوژیک فعال به نام انتقال اپیتلیال به مزانشیمی (EMT) در آن نقش محوری دارد. در محیط التهابی کرون، سلولهای اپیتلیال روده تحت تأثیر مقادیر بالای TNF و IL-13، ویژگیهای چسبندگی خود را از دست داده و به سلولهای شبهمزانشیمی تبدیل میشوند. این سلولها دارای توانایی مهاجرت و تهاجم بافتی هستند و با ترشح آنزیمهای پروتئولیتیک، مسیری را در دل دیواره روده حفر میکنند.
طبقهبندی و تظاهرات بالینی انواع فیستول
| نوع فیستول | مسیر ارتباطی | علائم شاخص |
|---|---|---|
| انترو-انتریک | بین دو حلقه از روده کوچک | اغلب بدون علامت؛ سوءجذب در موارد شدید |
| انترو-کولیک | بین روده کوچک و کولون | اسهال شدید، کاهش وزن، بایپس ایلئوم |
| انترو-وزیکال | بین روده و مثانه | پنوماتوری (خروج هوا در ادرار)، عفونتهای مکرر ادراری |
| رکتو-واژینال | بین رکتوم و واژن | خروج گاز یا مدفوع از واژن، دیسپارونیا |
| انترو-کوتانئوس | بین روده و سطح پوست | نشت محتویات روده از جدار شکم |
| پریآنال | بین کانال مقعد و پوست اطراف | درد، ترشح چرکی، آبسههای مکرر مقعدی |
فیستولهای پریآنال به ویژه به دلیل تأثیر مخرب بر کیفیت زندگی و عملکرد اسفنکتر، نیازمند مدیریت پیچیده شامل درمانهای بیولوژیک سیستمیک و مداخلات جراحی نظیر قرار دادن ستون (Seton) هستند.
تنگیهای فیبروتیک و انسداد روده
یکی دیگر از عوارض مستقیم التهاب ترانسمورال، تشکیل تنگی یا استریکچر (Stricture) است. این وضعیت نتیجه چرخههای مکرر التهاب حاد و به دنبال آن ترمیم ناصحیح بافت است که منجر به رسوب گسترده بافت همبند در دیواره روده میشود.
بیولوژی فیبروز روده و هیپرتروفی عضلانی
فیبروز در بیماری کرون یک فرآیند غیرفعال نیست. فاکتور رشد تغییردهنده بتا (TGF-β) به عنوان محرک اصلی این فرآیند شناخته میشود. با این حال، مطالعات بافتشناختی نشان دادهاند که تنگیها تنها ناشی از فیبروز نیستند؛ بلکه هیپرتروفی و هیپرپلازی شدید لایههای عضلانی سهم بزرگی در ضخیم شدن دیواره روده دارند. این تغییرات ساختاری منجر به کاهش قطر لومن روده شده و علائم انسدادی نظیر دردهای کرامپی شکم و استفراغ را ایجاد میکنند.
آبسههای داخل شکمی: تشکیل، تشخیص و تخلیه
آبسه (Abscess) به عنوان یک عارضه سپتیک، نتیجه مستقیم پرفوراسیون یا سوراخ شدن جدار روده در اثر التهاب ترانسمورال است. در بیماری کرون، پرفوراسیون معمولاً به صورت “محصور” (Contained) رخ میدهد. روده ملتهب به اندامهای مجاور میچسبد و محتویات نشت کرده را در یک فضای محدود محصور میکند که تشکیل آبسه میدهد.
استراتژی “پل به جراحی”: مدیریت مدرن آبسهها بر پایه رویکردی غیرتهاجمی استوار است. تخلیه از راه پوست تحت هدایت رادیولوژی (PAD) همراه با آنتیبیوتیکتراپی، التهاب را کنترل کرده و امکان جراحی الکتیو بعدی را با ریسک کمتر فراهم میکند.
مقایسه تطبیقی با کولیت اولسراتیو: مخاط در برابر تمامجدار
تمایز بین انتریت منطقهای و کولیت اولسراتیو تنها یک بحث آکادمیک نیست، بلکه پیامدهای درمانی و جراحی بسیار متفاوتی دارد.
| ویژگی | بیماری کرون | کولیت اولسراتیو |
|---|---|---|
| خونریزی رکتال | کمتر شایع و معمولاً متناوب | بسیار شایع و علامت اصلی |
| درد شکمی | شایع و اغلب در ربع تحتانی راست | کمتر شایع (معمولاً قبل از دفع) |
| تنگی و انسداد | بسیار شایع (ترانسمورال) | بسیار نادر |
| فیستول و آبسه | ویژگی شاخص بیماری | عملاً غایب |
| سیگار کشیدن | عامل خطر و تشدید کننده | عامل محافظتی (در برخی موارد) |
فرضیه نوتروفیل در مقابل ماکروفاژ
یک توضیح بیولوژیک جذاب برای تفاوت عمق درگیری، تفاوت در سلولهای ایمنی غالب است. در کولیت اولسراتیو، پاسخ ایمنی عمدتاً با واسطه نوتروفیلها است که عمر کوتاهی دارند و آسیب سطحی ایجاد میکنند. در انتریت منطقهای، ماکروفاژها نقش کلیدی دارند. ماکروفاژها میتوانند آنتیژنها را به اعماق دیواره روده حمل کنند و باعث جذب مجدد سلولهای ایمنی و ایجاد التهاب در تمام ضخامت دیواره شوند.
جراحی و تظاهرات خارج رودهای
جراحی در انتریت منطقهای: اصول و چالشها
جراحی در بیماری کرون بر خلاف کولیت اولسراتیو، هرگز به معنای درمان قطعی نیست. به دلیل ماهیت تکرار شونده بیماری، جراحان از اصول “صرفهجویی در روده” پیروی میکنند:
- استریکچروپلاستی: افزایش قطر روده بدون برداشتن بخش تنگ شده.
- رزکسیون سگمنتال کولون: برداشتن تنها بخش محدودی از کولون درگیر.
مصرف دخانیات قویترین عامل خطر قابل پیشگیری برای عود جراحی در کرون است.
تظاهرات خارج رودهای و عواقب سیستمیک
انتریت منطقهای یک بیماری محدود به روده نیست. التهاب ترانسمورال و ترشح سیتوکینهای سیستمیک منجر به تظاهرات خارج رودهای (EIM) میشود:
- مفاصل: آرتریت محیطی و آرتریت محوری (اسپوندیلیت آنکیلوزان).
- پوست: اریتم نودوزوم و پیودرما گانگرنوزوم.
- چشم: یووئیت و اپیاسکلریت.
- کبد: کلانژیت اسکلروزان اولیه (PSC).
نتیجهگیری و افقهای آینده
تحلیل جامع انتریت منطقهای نشان میدهد که این بیماری فراتر از یک التهاب ساده، یک فرآیند تخریبی و بازسازیکننده است که تمام لایههای جدار روده را درگیر میکند. ماهیت ترانسمورال بیماری، موتور محرک اصلی عوارضی چون فیستول، تنگی و آبسه است که هر کدام نیازمند رویکردهای درمانی و جراحی منحصر به فردی هستند. پدیده ضایعات پرشی و پتانسیل درگیری از دهان تا مقعد، لزوم ارزیابی کامل دستگاه گوارش را در هر بیمار مشکوک یادآور میشود.
با پیشرفت تکنولوژیهای تصویربرداری مقطعی و ظهور درمانهای بیولوژیک هدفمند که مسیرهایی نظیر IL-23 را هدف قرار میدهند، امید است که بتوان قبل از وقوع تغییرات ساختاری غیرقابل برگشت (فیبروز و فیستول)، سیر بیماری را تغییر داد. در نهایت، درک عمیق از بیولوژی فیبروز و مکانیسمهای EMT در تشکیل فیستول، کلید توسعه درمانهای نوین ضدفیبروتیک خواهد بود.
بازبینی توسط متخصص
بازبین علمی این مقاله
آیا نگران عوارض پیچیده بیماریهای گوارشی هستید؟
بیماریهایی مانند کرون میتوانند الگوهای وراثتی پیچیدهای داشته باشند. اگر سابقه خانوادگی بیماریهای التهابی روده دارید یا با عوارض مقاوم به درمان مواجه هستید، تیم ما آماده ارائه مشاوره ژنتیک تخصصی است.
دریافت مشاوره ژنتیک