تحولی بنیادین در پیوند سلولهای بنیادی
جایگزینی شیمیدرمانی با هدفگیری دقیق آنتیبادی
تاریخچه پزشکی در حوزه هماتولوژی و انکولوژی همواره با یک تضاد درونی بزرگ همراه بوده است؛ برای نجات جان بیمارانی که از نارساییهای مغز استخوان یا سرطانهای خون رنج میبرند، پزشکان ناگزیر بودهاند از روشهایی استفاده کنند که خود به شدت سمی و آسیبرسان هستند. پیوند سلولهای بنیادی خونساز (HSCT) دهههاست که به عنوان تنها راه درمان قطعی برای طیف وسیعی از اختلالات ژنتیکی و بدخیمیهای خونی شناخته میشود، اما پیشنیاز این پیوند، مرحلهای موسوم به «آمادهسازی» یا Conditioning است که در آن مغز استخوان بیمار باید با دوزهای بالای شیمیدرمانی یا پرتوتابی کل بدن (TBI) تخلیه شود تا فضا برای سلولهای اهدایی جدید باز شود. این فرآیند که در متون علمی به عنوان یک متد «سمی» و «غیرانتخابی» توصیف میشود، منجر به آسیبهای سیستمیک دائمی، از جمله نارسایی ارگانها، ناباروری، موکوزیت شدید و افزایش خطر ابتلا به سرطانهای ثانویه در آینده میشود.
دستاورد اخیر دانشمندان در دانشگاه پزشکی استنفورد، که در صدر آن پژوهشگرانی چون اگنیشکا چکوویچ (Agnieszka Czechowicz) و جودیت شیزورو (Judith Shizuru) قرار دارند، نقطه عطفی در تاریخ این حوزه محسوب میشود. این تیم تحقیقاتی موفق به ابداع روشی شدهاند که در آن، آنتیبادیهای اختصاصی جایگزین شیمیدرمانی و پرتوتابی مخرب میشوند. این متد که از آنتیبادی موسوم به بریکویلیماب (Briquilimab) یا JSP191 استفاده میکند، به طور دقیق سلولهای بنیادی معیوب را در مغز استخوان هدف قرار داده و بدون آسیب رساندن به سایر بافتهای بدن، فضا را برای پیوند موفقیتآمیز سلولهای سالم فراهم میکند. این رویکرد نه تنها بار سمی درمان را به شدت کاهش میدهد، بلکه امکان انجام پیوند را برای بیمارانی که پیش از این به دلیل ضعف جسمانی یا سن بالا از این درمان محروم بودند، فراهم میسازد.
مبانی بیولوژیکی و مکانیسم عمل آنتیبادیهای هدفمند
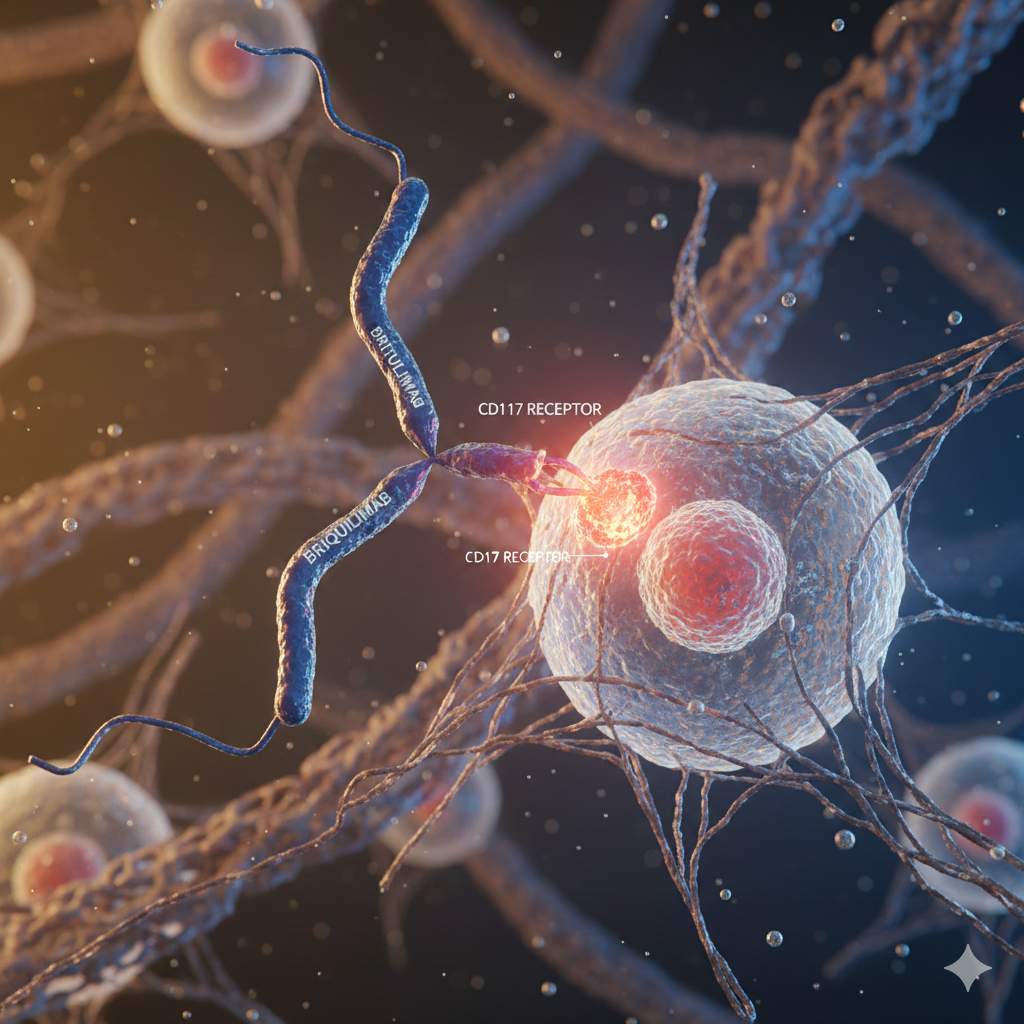
برای درک عمق این نوآوری، باید به میکرومحیط مغز استخوان و نقش حیاتی گیرنده CD117 توجه کرد. سلولهای بنیادی خونساز (HSCs) در فضاهای خاصی در مغز استخوان ساکن هستند که به آنها «نیش» (Niche) گفته میشود. بقا، تکثیر و خودنوسازی این سلولها به شدت به سیگنالهای دریافتی از گیرنده CD117 (که به عنوان c-Kit نیز شناخته میشود) وابسته است.
گیرنده CD117 و فاکتور سلول بنیادی (SCF)
در شرایط فیزیولوژیک، پروتئینتی به نام فاکتور سلول بنیادی (Stem Cell Factor یا SCF) به گیرنده CD117 روی سطح سلولهای بنیادی متصل شده و زنجیرهای از سیگنالهای بقا را فعال میکند. در روشهای سنتی آمادهسازی، داروهای آلکیلهکننده مانند بوسولفان (Busulfan) به طور غیرانتخابی تمام سلولهای در حال تقسیم سریع را از بین میبرند، که منجر به ریزش مو، تخریب پوشش روده و آسیب به کبد میشود.
آنتیبادی بریکویلیماب به عنوان یک مهارکننده رقابتی عمل میکند. این آنتیبادی به گیرنده CD117 متصل شده و مانع از اتصال SCF به آن میشود. با قطع این سیگنال حیاتی، سلولهای بنیادی میزبان دچار آپوپتوز (مرگ برنامهریزی شده سلولی) شده یا از نیشهای خود جدا میشوند، بدون آنکه آسیبی به سلولهای بالغ خون، سلولهای عصبی یا ارگانهای حیاتی وارد شود. این مکانیسم «پاکسازی ملایم» اجازه میدهد تا سلولهای اهدایی جدید به راحتی در جایگاههای خالی مستقر شوند.
مدلسازی فارماکوکینتیک و پنجره زمانی پیوند
یکی از چالشهای فنی در استفاده از آنتیبادیها، مدیریت زمانبندی تزریق سلولهای اهدایی است. اگر آنتیبادی بیش از حد در خون باقی بماند، ممکن است سلولهای اهدایی جدید را نیز هدف قرار داده و از بین ببرد. تحقیقات استنفورد منجر به توسعه مدلهای فارماکوکینتیک (PK) دقیقی شده است که نشان میدهد بریکویلیماب با الگویی پیشبینیپذیر از بدن دفع میشود.
| پارامتر فارماکوکینتیک | مقدار تخمینی (در یک بزرگسال ۷۰ کیلوگرمی) |
|---|---|
| حجم توزیع مرکزی | 3444.0 mL |
| حجم توزیع محیطی | 1613.3 mL |
| نرخ پاکسازی (Clearance) | 17.6 mL/h |
| نیمهعمر نهایی حذف | حدود ۱۲ روز |
| غلظت هدف برای پیوند | کمتر از 500 – 2000 ng/mL |
| زمان متوسط رسیدن به غلظت هدف | ۷.۷ تا ۱۲.۳ روز (دوز 0.6 mg/kg) |
دادههای بالینی تأیید میکنند که تزریق سلولهای اهدایی معمولاً ۹ تا ۱۴ روز پس از یک نوبت تزریق وریدی بریکویلیماب کاملاً ایمن است. این پیشبینیپذیری به پزشکان اجازه میدهد تا فرآیند پیوند را با دقت بالایی برنامهریزی کنند و حتی بخشهایی از درمان را به صورت سرپایی انجام دهند.
مطالعه موردی: موفقیت در درمان کمخونی فانکونی
کمخونی فانکونی (FA) یک اختلال ژنتیکی نادر است که در آن توانایی بدن برای ترمیم آسیبهای DNA مختل میشود. کودکان مبتلا به این بیماری به شدت در برابر شیمیدرمانی و رادیوتراپی حساس هستند؛ سلولهای آنها نمیتوانند شکستهای ایجاد شده توسط این سموم را ترمیم کنند، که منجر به مرگ و میر ناشی از درمان یا بروز سرطانهای تهاجمی در سنین بسیار پایین (اغلب پیش از ۴۰ سالگی) میشود.
جزئیات کارآزمایی بالینی فاز ۱ب
در یک مطالعه پیشگامانه که نتایج آن در ژورنال Nature Medicine منتشر شد، محققان استنفورد از پروتکل بدون بوسولفان و بدون پرتوتابی برای کودکان مبتلا به نارسایی مغز استخوان ناشی از FA استفاده کردند. در این مطالعه، بیماران تنها یک دوز 0.6 mg/kg از بریکویلیماب را همراه با یک رژیم سرکوب سیستم ایمنی با شدت پایین دریافت کردند تا از رد پیوند جلوگیری شود.
| شاخص بالینی | روش سنتی (تاریخی) | پروتکل مبتنی بر بریکویلیماب |
|---|---|---|
| عوامل آمادهسازی | بوسولفان، سیکلوفسفامید، TBI | بریکویلیماب، فلودارابین، ATG، ریتوکسیماب |
| بروز موکوزیت (زخم دهانی) | ۱۰۰٪ (درجه بالا) | حداقل تا صفر |
| نارسایی کبدی (VOD) | خطر بالا | ۰٪ |
| زمان پیوند نوتروفیل | ۱۵ تا ۲۵ روز | میانگین ۱۱ روز (محدوده ۱۱-۱۳) |
| کیمریسم اهدایی در ۲ سال | متغیر و اغلب ناقص | ۹۹٪ تا ۱۰۰٪ |
| بیماری پیوند علیه میزبان (GVHD) | خطر قابل توجه | ۰٪ |
یکی از نمونههای درخشان این درمان، رایدر بیکر (Ryder Baker)، پسر ۱۱ سالهای است که پیش از درمان از خستگی مفرط و نارسایی شدید خونی رنج میبرد. پس از دریافت پیوند با آمادهسازی بریکویلیماب، او به کیمریسم ۱۰۰٪ دست یافت؛ به این معنی که تمام سیستم خونی او با سلولهای سالم اهدایی جایگزین شد، بدون آنکه عوارضی نظیر ریزش مو، تهوع شدید یا آسیبهای ارگانیک ماندگار را تجربه کند. پیگیریهای دو ساله نشان میدهند که تمامی شرکتکنندگان در این کارآزمایی در سلامت کامل به سر میبرند و پیوند آنها پایدار باقی مانده است.
مهندسی پیوند و گسترش دایره اهداکنندگان
علاوه بر سمی بودن شیمیدرمانی، دومین مانع بزرگ در پیوند سلولهای بنیادی، کمبود اهداکنندگان کاملاً سازگار است. حدود ۳۵٪ تا ۴۰٪ از بیمارانی که به پیوند نیاز دارند، موفق به یافتن اهداکننده مناسب نمیشوند. تیم استنفورد برای حل این مشکل، مهندسی پیشرفته گراف (Graft Engineering) را با آمادهسازی آنتیبادی ترکیب کرده است.
حذف سلولهای TCRαβ+ و سلولهای CD19+
دکتر آلیس برتاینا (Alice Bertaina) روشی را ابداع کرد که در آن، سلولهای اهدایی پیش از تزریق به بیمار در آزمایشگاه پردازش میشوند. در این متد، سلولهای T از نوع $\alpha\beta$ که عامل اصلی بروز بیماری پیوند علیه میزبان (GVHD) هستند، به طور انتخابی حذف میشوند، اما سلولهای حمایتی مانند سلولهای NK و سلولهای T نوع گاما-دلتا حفظ میگردند.
این نوآوری به بیماران اجازه میدهد تا از اهداکنندگان «هاپلو-اینتیکال» (نیمه-سازگار) مانند والدین خود پیوند دریافت کنند. ترکیب آمادهسازی با بریکویلیماب و استفاده از گرافهای مهندسی شده، عملاً به این معناست که اکنون تقریباً هر بیماری که به پیوند نیاز دارد، میتواند یک اهداکننده در میان اعضای خانواده خود پیدا کند.
تحلیل تطبیقی: بریکویلیماب در برابر رقبا
در دنیای بیوتکنولوژی، استراتژیهای مختلفی برای جایگزینی شیمیدرمانی دنبال شده است که مهمترین آنها شامل آنتیبادیهای خالص (مانند بریکویلیماب) و آنتیبادیهای جفت شده با دارو (Antibody-Drug Conjugates یا ADCs) است.
برتری مکانیکی بریکویلیماب بر ADCs
بریکویلیماب یک آنتیبادی «برهنه» یا خالص است که تنها با مسدود کردن سیگنال طبیعی رشد عمل میکند. این رویکرد به طور ذاتی ایمنتر است زیرا هیچ سم خارجی به بدن تزریق نمیشود. عوارض جانبی آن بسیار محدود و شامل کاهش موقتی و پیشبینیپذیر نوتروفیلهاست که با دفع آنتیبادی به سرعت بهبود مییابد.
در مقابل، شرکتهایی مانند ماژنتا تراپوتیکس (Magenta Therapeutics) روی محصولی به نام MGTA-117 کار میکردند که در آن یک آنتیبادی ضد CD117 به سمی به نام «آمانیتین» متصل شده بود. هدف این بود که سم مستقیماً به درون سلولهای بنیادی منتقل شود. با این حال، در سال ۲۰۲۳، آزمایشهای بالینی MGTA-117 به دلیل بروز عوارض شدید و مرگ یک بیمار در اثر نارسایی تنفسی و ایست قلبی متوقف و کل پروژه لغو شد. این واقعه نشان داد که مدیریت دوز سموم در ADCs چقدر دشوار است و رویکرد پاکسازی ملایم استنفورد از امنیت بالاتری برخوردار است.
| ویژگی | بریکویلیماب (استنفورد/جاسپر) | MGTA-117 (ماژنتا – لغو شده) |
|---|---|---|
| نوع دارو | آنتیبادی منوکلونال خالص (IgG1) | آنتیبادی جفت شده با دارو (ADC) |
| مکانیسم اثر | مسدود کردن سیگنال SCF/c-Kit | آزادسازی سم آمانیتین درون سلول |
| سمیت سیستمیک | بسیار پایین؛ بدون آسیب به ارگانها | خطر بالای سمیت ریوی و قلبی |
| وضعیت بالینی | در حال انجام فاز ۲ و ۳ | توقف کامل به دلیل مرگ بیمار |
| پیوند کیمریسم | پایدار و نزدیک به ۱۰۰٪ | متغیر در دوزهای پایین |
کاربردهای گسترده: از دیابت نوع ۱ تا بیماریهای خودایمنی
یکی از هیجانانگیزترین ابعاد این تکنولوژی، پتانسیل آن برای درمان بیماریهای غیرسرطانی است. در بسیاری از بیماریهای خودایمنی، سیستم ایمنی بدن به اشتباه به بافتهای خودی حمله میکند. «بازنشانی» (Reset) سیستم ایمنی از طریق پیوند سلولهای بنیادی میتواند این بیماریها را درمان کند، اما خطر مرگ ناشی از شیمیدرمانی پیوند، مانع از استفاده گسترده از این روش برای بیماریهای غیرمرگبار شده بود.
درمان قطعی دیابت نوع ۱ در مدلهای حیوانی
محققان استنفورد به سرپرستی دکتر جودیت شیزورو و دکتر سئونگ کیم، نشان دادند که با استفاده از آمادهسازی ملایم مبتنی بر آنتیبادی، میتوان حالتی به نام «کیمریسم مخلوط» ایجاد کرد. در این حالت، سلولهای ایمنی خود بیمار و سلولهای اهدایی به طور مسالمتآمیز در کنار هم زندگی میکنند و این حضور سلولهای اهدایی، سیستم ایمنی بیمار را «دوباره آموزش» میدهد تا به سلولهای پانکراس حمله نکند.
در آزمایشهایی که روی موشهای مبتلا به دیابت خودایمنی انجام شد، این تیم موفق شد:
- بدون نیاز به پرتوتابی یا شیمیدرمانی، سلولهای بنیادی جدید را مستقر کند.
- امکان پیوند سلولهای جزایر لانگرهانس پانکراس را بدون نیاز به داروهای سرکوبکننده ایمنی دائمی فراهم سازد.
- بیماری دیابت را در ۱۰۰٪ نمونههای تحت درمان به طور کامل و دائمی معکوس کند.
این موفقیت به این معناست که در آینده نزدیک، بیماران مبتلا به دیابت نوع ۱ یا بیماریهایی مانند لوپوس و اماس (MS) میتوانند با یک دوره کوتاه درمان آنتیبادی و پیوند سلولهای بنیادی، برای همیشه از شر بیماری و مصرف داروهای انسولین یا کورتون خلاص شوند.
افقهای آینده در درمان سرطانهای خون (AML/MDS)
برای بیماران مسن مبتلا به لوسمی حاد میلوئیدی (AML) یا سندرمهای میلودیسپلاستیک (MDS)، پیوند سلولهای بنیادی اغلب تنها راه نجات است، اما بسیاری از این بیماران (میانگین سنی ۷۰ سال) توان تحمل شیمیدرمانی شدید را ندارند.
تحقیقات اخیر نشان میدهند که افزودن بریکویلیماب به رژیمهای آمادهسازی با شدت پایین (RIC) میتواند نرخ موفقیت پیوند را بدون افزایش مرگ و میر ناشی از درمان، به طور چشمگیری افزایش دهد. در یک مطالعه روی بیماران ۷۰ ساله، استفاده از این آنتیبادی منجر به:
- دستیابی به کیمریسم کامل میلوئیدی (۹۸.۵٪) در روز ۹۰ پس از پیوند شد.
- نرخ بقای بدون عود ۶۷٪ در سال اول برای بیماران لوسمی حاصل گردید.
- هیچ موردی از عوارض سمی شدید مرتبط با آنتیبادی گزارش نشد.
این رویکرد به معنای دموکراتیزه کردن پیوند است؛ درمانی که روزی تنها مخصوص جوانان سالم بود، اکنون برای پدربزرگها و مادربزرگها نیز در دسترس قرار میگیرد.
وضعیت رگولاتوری و مسیر تجاریسازی
اهمیت بالینی این نوآوری باعث شده است که سازمانهای نظارتی بینالمللی مانند FDA (ایالات متحده) و EMA (اروپا) امتیازات ویژهای را برای تسریع در توسعه بریکویلیماب در نظر بگیرند.
- تأییدیه داروی یتیم (Orphan Drug Designation): برای درمان کمخونی فانکونی، بیماری نقص ایمنی مرکب شدید (SCID) و لوسمی حاد.
- وضعیت مسیر سریع (Fast Track): برای تسریع در بررسی دادههای بالینی و رساندن سریعتر دارو به بازار.
توسعه توسط Jasper Therapeutics: این شرکت بیوتکنولوژی که از دل تحقیقات استنفورد بیرون آمده، در حال حاضر هدایت کارآزماییهای فاز ۲ و ۳ را بر عهده دارد.
علاوه بر پیوند، این شرکت در حال بررسی بریکویلیماب برای درمان بیماریهای ماستسل (Mast Cell) مانند کهیر مزمن و آسم است، زیرا گیرنده CD117 روی سطح ماستسلها نیز وجود دارد. این کاربرد دوگانه، ارزش اقتصادی و درمانی این آنتیبادی را دوچندان میکند.
نتیجهگیری: عبور از عصر سموم به عصر دقت
ابداع روش پیوند بدون شیمیدرمانی در دانشگاه استنفورد، فراتر از یک پیشرفت علمی ساده، یک تغییر پارادایم اخلاقی در پزشکی است. ما در حال عبور از دورانی هستیم که در آن برای کشتن سلولهای سرطانی، ناچار بودیم کل بدن بیمار را به مرز نابودی بکشانیم. رویکرد جدید که مبتنی بر درک عمیق بیولوژی سلولهای بنیادی و قدرت آنتیبادیهای منوکلونال است، پیوند مغز استخوان را به یک روش «جراحی مولکولی» دقیق تبدیل میکند.
حذف سموم ژنوتوکسیک نه تنها جان بیماران را در کوتاه مدت حفظ میکند، بلکه از بروز فجایع آینده مانند سرطانهای ثانویه و نارساییهای مزمن ارگانها جلوگیری مینماید. با ترکیب این روش با مهندسی ژنتیک و پیوندهای نیمه-سازگار، رویای «درمان برای همه» در حال تبدیل شدن به واقعیت است. همانطور که رایدر بیکر و دیگر کودکان این کارآزمایی نشان دادند، آینده پزشکی دیگر در گرو سموم نیست، بلکه در گرو دقت و مهربانی با سلولهای بدن انسان است. این گزارش تأیید میکند که ما در آستانه عصری هستیم که در آن واژه «شیمیدرمانی» ممکن است به تدریج از فرهنگ لغات درمانهای پیوندی حذف شود.
بازبینی توسط متخصص
بازبین علمی این مقاله
آیا نگران عوارض پیوند مغز استخوان هستید؟
فناوریهای نوین مانند استفاده از آنتیبادیها به جای شیمیدرمانی، افقهای جدیدی را برای بیماران نیازمند پیوند گشودهاند. اگر سوالی در مورد گزینههای درمانی جدید یا سازگاری ژنتیکی برای پیوند دارید، تیم ما آماده ارائه مشاوره تخصصی است.
دریافت مشاوره ژنتیک