پروفایل جامع بالینی و پاتوفیزیولوژیک زخمهای معده (Gastric Ulcer)
تحلیل مکانیسمهای آسیب مخاطی، دینامیک تغذیهای و تمایز بدخیمیها
۱. مقدمه و کلیات: تعریف و بار بیماری
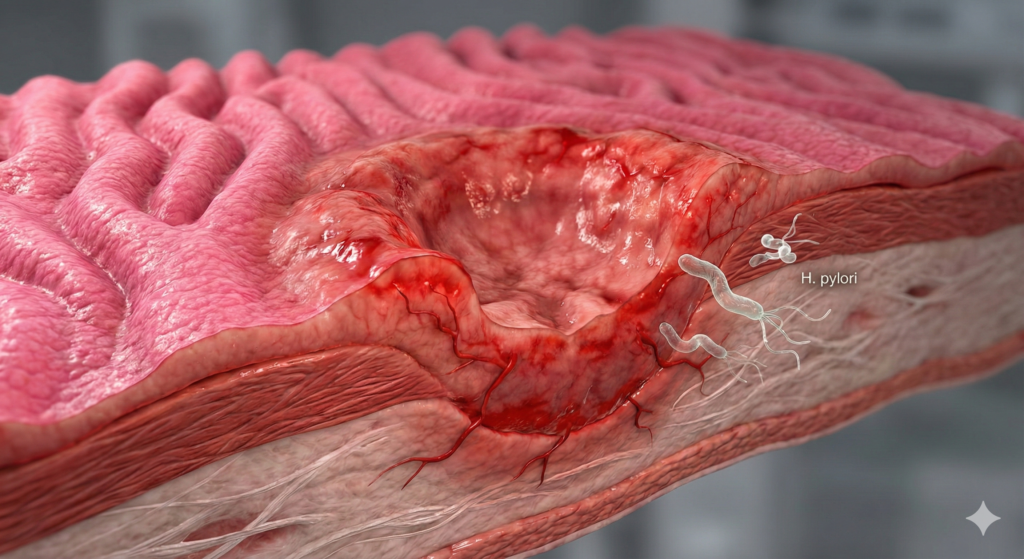
زخم معده (Gastric Ulcer) به عنوان یکی از دو تظاهر اصلی بیماری پپتیک اولسر (Peptic Ulcer Disease – PUD)، نمایانگر یک گسستگی عمیق و پاتولوژیک در تمامیت ساختاری مخاط معده است. از دیدگاه هیستوپاتولوژیک، این ضایعه به عنوان یک نقص کانونی تعریف میشود که از لایه عضلانی مخاط (Muscularis Mucosa) عبور کرده و به عمق لایه زیرمخاط (Submucosa) یا حتی لایه عضلانی اصلی (Muscularis Propria) نفوذ میکند. این عمق نفوذ، زخم واقعی را از “اروزیون” (Erosion) یا سایش سطحی که محدود به مخاط است و آسیب عمیقی به لایه عضلانی مخاط نمیزند، متمایز میسازد. زخمهای معده معمولاً قطری بیش از ۵ میلیمتر دارند و میتوانند به صورت ضایعات منفرد یا متعدد ظاهر شوند.
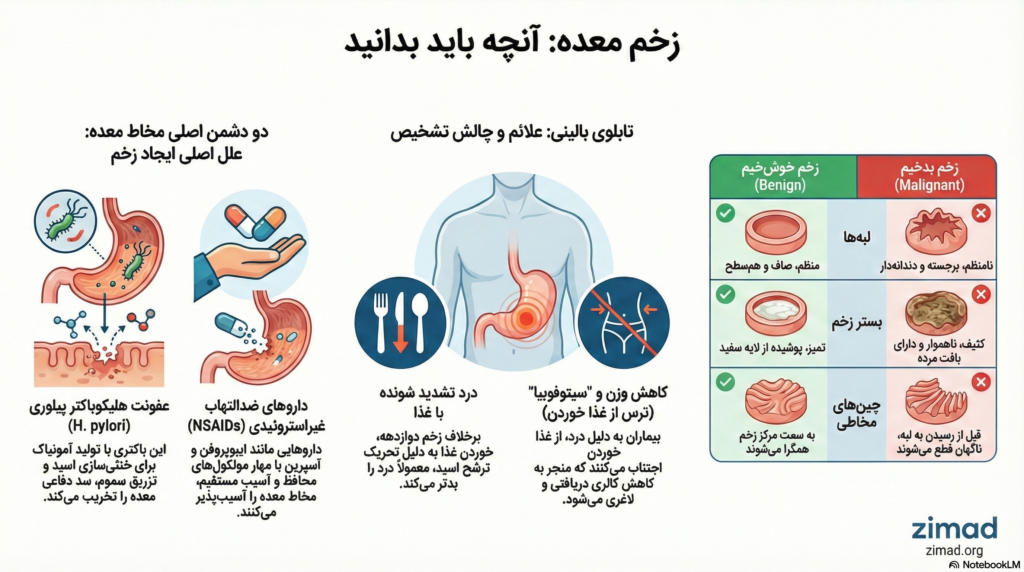
اهمیت بالینی زخم معده فراتر از یک بیماری التهابی ساده است؛ این وضعیت بازتابی از شکست در تعادل هموستاتیک بین عوامل تهاجمی luminal (مانند اسید هیدروکلریک و پپسین) و مکانیسمهای دفاعی پیچیده مخاطی است. در حالی که در گذشته تصور میشد که “بدون اسید، زخمی وجود ندارد” (No acid, no ulcer)، درک مدرن پاتوفیزیولوژی بر این اصل استوار است که زخم معده، بر خلاف زخم دوازدهه که اغلب با افزایش ترشح اسید همراه است، عمدتاً نتیجه “نقص در دفاع مخاطی” است، حتی در حضور مقادیر نرمال یا پایین اسید. این تغییر پارادایم، توجه محققان را به سمت عواملی جلب کرده است که سد دفاعی را تضعیف میکنند، به ویژه عفونت Helicobacter pylori و مصرف داروهای ضدالتهاب غیراستروئیدی (NSAIDs).
علاوه بر بار علامتی قابل توجه، زخمهای معده پتانسیل بالایی برای ایجاد عوارض تهدیدکننده حیات دارند. خونریزی گوارشی (Gastrointestinal Bleeding)، سوراخشدگی (Perforation) به حفره صفاق که منجر به پریتونیت شیمیایی و باکتریایی میشود، و انسداد خروجی معده (Gastric Outlet Obstruction) ناشی از ادم یا اسکار فیبروتیک، از جمله این عوارض هستند. چالش بزرگ دیگر در مدیریت بالینی این زخمها، همپوشانی قابل توجه نمای ظاهری و علائم بالینی آنها با بدخیمیهای معده، به ویژه آدنوکارسینوم اولسره و لنفوم MALT است. این شباهت، ضرورت افتراق دقیق با استفاده از معیارهای مورفولوژیک پیشرفته و نمونهبرداریهای بافتی (Biopsy) را اجتنابناپذیر میسازد.
این گزارش جامع با هدف ارائه تحلیلی عمیق از زخمهای معده تدوین شده است و به بررسی دقیق مکانیسمهای مولکولی آسیب سلولی، فیزیولوژی درد و تشدید آن با غذا، اثرات متابولیک و تغذیهای بیماری (شامل کاهش وزن و سیتوفوبیا)، و استراتژیهای تشخیصی برای رد بدخیمیها میپردازد.
۲. آناتومی عملکردی و فیزیولوژی دفاع مخاطی معده
برای درک چگونگی ایجاد زخم، ابتدا باید مکانیسمهایی را شناخت که معده را قادر میسازند در برابر محیط شیمیایی فوقالعاده خشن خود مقاومت کند. لومن معده حاوی اسید هیدروکلریک با pH بین ۱ تا ۲ و آنزیم پروتئولیتیک پپسین است که توانایی هضم اکثر بافتهای بیولوژیک را دارد. بقای مخاط معده در این محیط وابسته به یک “سد مخاطی معده” (Gastric Mucosal Barrier) چندلایه و یکپارچه است.
۲.۱. خط اول دفاع: لایه پیشاپیتلیال (Pre-epithelial Defense)
این لایه اولین مانع فیزیکی در برابر عوامل مهاجم است و شامل دو جزء اصلی است:
- ژل موکوس (Mucus Gel Layer): سلولهای فویولار سطحی به طور مداوم موسین ترشح میکنند. این موسینها یک ژل ویسکوالاستیک و چسبنده را تشکیل میدهند که سطح مخاط را میپوشاند. این لایه نه تنها به عنوان یک روانکننده عمل میکند، بلکه به دلیل خاصیت ژلی خود، از انتشار سریع یونهای هیدروژن (H+) و مولکولهای بزرگ پپسین به سمت سلولها جلوگیری میکند.
- لایه آبکی بیکربنات (Unstirred Water Layer): سلولهای اپیتلیال سطحی همچنین یون بیکربنات (HCO3-) ترشح میکنند که در لایه موکوس به دام میافتد. تعامل بین بیکربنات و یونهای هیدروژن نفوذ کرده از لومن، باعث ایجاد یک “گرادیان pH” میشود. در حالی که pH لومن ممکن است ۱ یا ۲ باشد، pH در سطح سلولهای اپیتلیال در محدوده خنثی (حدود ۷) حفظ میشود. این خنثیسازی موضعی حیاتیترین مکانیسم برای جلوگیری از سوختگی شیمیایی سلولها است.
علاوه بر این، یک لایه از فسفولیپیدهای فعال سطحی (Surface Active Phospholipids) که خاصیت هیدروفوبیک دارند، بر روی لایه موکوس قرار میگیرد و از تماس مستقیم فاز مایع اسیدی با سطح سلول جلوگیری کرده و “تراوایی انتخابی” را کاهش میدهد.
۲.۲. خط دوم دفاع: لایه اپیتلیال (Epithelial Defense)
اگر اسید از لایه موکوس عبور کند، خود سلولهای اپیتلیال و اتصالات بین آنها باید مقاومت کنند.
- اتصالات محکم (Tight Junctions): غشای سلولهای اپیتلیال و اتصالات محکم بین آنها مانع از نفوذ یونهای H+ به فضای بین سلولی میشوند. این اتصالات قطبیت سلول را حفظ کرده و از نشت محتویات لومن به بافت زیرین جلوگیری میکنند.
- ترمیم سریع (Restitution): در صورتی که آسیب سطحی رخ دهد، مکانیسم ترمیم سریع فعال میشود. در این فرآیند که مستقل از تقسیم سلولی است، سلولهای سالم مجاور با تغییر شکل (پهن شدن) و مهاجرت سریع بر روی غشای پایه، ناحیه آسیبدیده را میپوشانند. این فرآیند در عرض ۱۵ تا ۳۰ دقیقه پس از آسیب رخ میدهد.
- پمپهای یونی و بافرینگ داخل سلولی: سلولهای اپیتلیال دارای پمپهای Na+/H+ و مبادلهگرهای Cl-/HCO3- هستند که به آنها اجازه میدهد pH سیتوپلاسمی خود را در صورت نفوذ اسید تنظیم کنند.
۲.۳. خط سوم دفاع: لایه پساپیتلیال (Post-epithelial Defense)
جریان خون مخاطی (Mucosal Blood Flow) نقش حیاتی در حفظ تمامیت مخاط دارد. یک شبکه مویرگی غنی در زیر غشای پایه قرار دارد که سه وظیفه اصلی را انجام میدهد:
- تأمین اکسیژن و مواد مغذی برای فعالیت متابولیک بالای سلولهای ترشحی و ترمیمی.
- تحویل بیکربنات: بیکربنات مورد نیاز برای ترشح به لومن از طریق خون تأمین میشود.
- شستشوی اسید (Washout of Acid): اگر یونهای H+ موفق به عبور از اپیتلیوم شوند و به بافت بینابینی برسند، جریان خون سریع آنها را رقیق کرده و دور میکند تا از تجمع سمی آنها و نکروز بافتی جلوگیری شود.
۲.۴. نقش محوری پروستاگلاندینها (Prostaglandins)
پروستاگلاندینها، به ویژه PGE2 و PGI2، به عنوان تنظیمکننده اصلی تمام این لایههای دفاعی عمل میکنند. آنها از طریق متابولیسم اسید آراشیدونیک توسط آنزیم سیکلواکسیژناز-۱ (COX-1) به طور مداوم در مخاط معده تولید میشوند:
- تحریک ترشح موکوس و بیکربنات.
- افزایش جریان خون مخاطی از طریق گشاد کردن عروق (Vasodilation).
- حفظ یکپارچگی اتصالات محکم و تحریک ترمیم سلولی.
- مهار ترشح اسید از سلولهای پاریتال (اثر آنتیسکرتوری).
۳. پاتوفیزیولوژی آسیب مخاطی ناشی از NSAIDs
داروهای ضدالتهاب غیراستروئیدی (NSAIDs) مانند آسپرین، ایبوپروفن، ناپروکسن و دیکلوفناک، یکی از شایعترین علل ایجاد زخم معده هستند. آسیب ناشی از این داروها حاصل تعامل پیچیدهای بین اثرات موضعی (Topical) و سیستمیک (Systemic) است که منجر به درهم شکستن دفاع مخاطی میشود.
۳.۱. تئوری به دام افتادن یون (Ion Trapping) و فرضیه پارتیشن pH
یکی از مکانیسمهای اولیه آسیب NSAIDها، اثر موضعی و مستقیم آنها بر سلولهای اپیتلیال سطحی است که مستقل از مهار پروستاگلاندینها رخ میدهد. این پدیده تحت عنوان “فرضیه پارتیشن pH” (pH Partition Hypothesis) یا تئوری به دام افتادن یون شناخته میشود.
اکثر NSAIDها اسیدهای ضعیف (Weak Organic Acids) با pKa پایین هستند. در محیط به شدت اسیدی لومن معده (pH 1-2)، این داروها به شکل پروتونه و غیر-یونیزه (Lipophilic) وجود دارند. فرم غیر-یونیزه به دلیل حلالیت بالا در چربی، به راحتی از غشای لیپیدی سلولهای اپیتلیال عبور کرده و وارد سیتوپلاسم میشود.
داخل سلول اپیتلیال، pH فیزیولوژیک و نزدیک به خنثی (حدود ۷.۴) است. در این pH، اسید ضعیف تفکیک شده و پروتون (H+) خود را از دست میدهد و به فرم یونیزه (آنیون با بار منفی) تبدیل میشود.
R-COOH → R-COO– + H+
فرم یونیزه به دلیل بار الکتریکی و خاصیت لیپوفوبیک (آبدوست)، قادر به عبور مجدد از غشای سلولی و خروج از سلول نیست. این ناتوانی در خروج، در حالی که ورود دارو از لومن ادامه دارد، منجر به تجمع گسترده دارو در داخل سلول میشود که به آن “به دام افتادن یون” (Ion Trapping) میگویند. غلظت داخل سلولی NSAID میتواند به چندین برابر غلظت خارج سلولی برسد.
عواقب سیتوتوکسیک به دام افتادن یون:
- جدا کردن فسفوریلاسیون اکسیداتیو (Uncoupling of Oxidative Phosphorylation): تجمع آنیونهای NSAID در میتوکندری باعث اختلال در پتانسیل غشای میتوکندری و قطع تولید ATP میشود.
- تولید رادیکالهای آزاد: اختلال در زنجیره تنفسی منجر به نشت الکترون و تولید گونههای فعال اکسیژن (ROS) میشود که به لیپیدهای غشا و DNA سلولی آسیب میزند.
- افزایش نفوذپذیری غشا: آسیب اکسیداتیو و کمبود انرژی باعث نشت یونها و ادم سلولی و در نهایت نکروز سلولهای سطحی میشود.
۳.۲. مهار سیستمیک سیکلواکسیژناز (COX) و نقص پروستاگلاندین
مهمترین مکانیسم آسیبزایی NSAIDها، اثر سیستمیک آنها در مهار آنزیمهای سیکلواکسیژناز (COX) است که مسئول تبدیل اسید آراشیدونیک به پروستاگلاندینها هستند.
- مهار COX-1: آنزیم COX-1 ایزوفرمی است که به طور مداوم در معده بیان میشود و مسئول تولید پروستاگلاندینهای محافظتی (PGE2, PGI2) است. مهار این آنزیم توسط NSAIDهای غیرانتخابی باعث کاهش شدید جریان خون مخاطی، کاهش ترشح موکوس و بیکربنات، و اختلال در تکثیر سلولی میشود. این تضعیف دفاعی، مخاط را در برابر اسید خودی و پپسین آسیبپذیر میکند.
- مهار COX-2: آنزیم COX-2 معمولاً در بافتهای ملتهب القا میشود، اما تحقیقات نشان دادهاند که بیان آن در حاشیه زخمهای معده برای تسریع بهبودی و آنژیوژنز (رگزایی) ضروری است. بنابراین، مهار COX-2 توسط NSAIDها (حتی انواع انتخابی) میتواند فرآیند ترمیم زخم را مختل کند.
- سینرژیسم مهاری: مطالعات نشان میدهند که برای ایجاد زخمهای کامل و عمیق، مهار همزمان COX-1 و COX-2 لازم است. مهار COX-1 دفاع را تضعیف میکند و مهار COX-2 مانع از مکانیسمهای جبرانی و ترمیمی میشود.
۳.۳. نقش ایسکمی ریزعروقی و نوتروفیلها
مهار مسیر COX باعث میشود متابولیسم اسید آراشیدونیک به سمت مسیر لیپواکسیژناز (5-LOX) منحرف شود که محصول آن لکوترینها (Leukotrienes) است. لکوترینها، به ویژه LTB4، عوامل قوی در جذب و فعالسازی نوتروفیلها هستند.
- چسبندگی نوتروفیلها: NSAIDها باعث افزایش بیان مولکولهای چسبندگی (مانند ICAM-1) بر روی اندوتلیوم عروق مخاطی میشوند. نوتروفیلهای فعال شده به دیواره مویرگها میچسبند و باعث انسداد فیزیکی میکروسیرکولاسیون میشوند.
- ایسکمی بافتی: انسداد مویرگی منجر به کاهش جریان خون موضعی و ایسکمی میشود که سلولها را مستعد نکروز میکند.
- آسیب اکسیداتیو: نوتروفیلهای چسبیده رادیکالهای آزاد و پروتئازها را آزاد میکنند که مستقیماً به اندوتلیوم و اپیتلیوم آسیب میرساند.
۴. پاتوفیزیولوژی آسیب ناشی از Helicobacter pylori
باکتری H. pylori یک پاتوژن گرم منفی مارپیچی است که با مکانیسمهای پیچیدهای سد دفاعی معده را در هم میشکند و باعث التهاب مزمن و زخم میشود. این باکتری مسئول اکثریت موارد زخمهای معده (غیر دارویی) است.
۴.۱. کلونیزاسیون و بقا در محیط اسیدی
H. pylori برای بقا در معده از آنزیم قدرتمند اوره آز (Urease) استفاده میکند. این آنزیم اوره موجود در پلاسما و شیره معده را به آمونیاک (NH3) و دیاکسید کربن هیدرولیز میکند. آمونیاک یک باز قوی است که اسید اطراف باکتری را خنثی کرده و یک “ابر محافظتی” با pH خنثی در اطراف باکتری ایجاد میکند. با این حال، آمونیاک تولید شده مستقیماً برای سلولهای اپیتلیال سمی است و باعث آسیب بافتی میشود.
۴.۲. فاکتورهای ویرولانس و تخریب اتصالات سلولی
سویههای بیماریزای H. pylori دارای جزایر پاتوژنیسیته (Pathogenicity Islands) هستند که پروتئینهای سمی خاصی را کد میکنند.
۴.۲.۱. CagA و اختلال در اتصالات محکم
پروتئین CagA (Cytotoxin-associated gene A) یکی از مهمترین فاکتورهای ویرولانس است. این پروتئین از طریق یک سیستم تزریق مولکولی پیچیده به نام سیستم ترشحی نوع ۴ (Type IV Secretion System – T4SS)، مانند یک سرنگ، مستقیماً از باکتری به سیتوپلاسم سلول اپیتلیال میزبان تزریق میشود.
- فسفوریلاسیون و سیگنالینگ: پس از ورود، CagA توسط کینازهای میزبان فسفوریله میشود. CagA فسفوریله شده با تیروزین فسفاتاز SHP-2 تعامل میکند و باعث فعالسازی مسیرهای سیگنالینگ غیرطبیعی میشود که منجر به تغییر اسکلت سلولی و کشیدگی سلولها (“Hummingbird phenotype”) میگردد.
- تخریب Tight Junctions: مطالعات نشان دادهاند که CagA مستقیماً به پروتئینهای اتصال محکم مانند ZO-1 و JAM متصل میشود و باعث جابجایی آنها از غشای جانبی و تخریب کمپلکسهای اتصالی میشود. این امر باعث باز شدن فضای پاراسلولی و نشت مواد مغذی به بیرون (برای تغذیه باکتری) و نفوذ اسید و فاکتورهای التهابی به عمق بافت میشود.
۴.۲.۲. VacA و واکوئلسازی
سیتوتوکسین VacA (Vacuolating cytotoxin A) یک توکسین حفرهساز (Pore-forming) است که توسط اکثر سویهها ترشح میشود.
- آسیب سلولی: VacA وارد غشای اندوزومهای سلول میزبان شده و کانالهای کلرید ایجاد میکند که منجر به تورم اسموتیک و تشکیل واکوئلهای بزرگ در سیتوپلاسم میشود.
- هدفگیری میتوکندری: VacA میتواند به میتوکندری نفوذ کرده و با آزادسازی سیتوکروم c، مسیر آپوپتوز (مرگ برنامهریزی شده سلول) را فعال کند.
- شلی اتصالات: VacA نیز مانند CagA میتواند نفوذپذیری اپیتلیال را با تأثیر بر اتصالات محکم افزایش دهد.
۴.۳. التهاب مزمن و پاسخ ایمنی
H. pylori باعث القای ترشح کموکینهای قوی مانند IL-8 از سلولهای اپیتلیال میشود. IL-8 نوتروفیلها، ماکروفاژها و لنفوسیتها را به مخاط فرامیخواند. پاسخ ایمنی میزبان منجر به تولید سیتوکینهای التهابی (TNF-α, IL-1β, IFN-γ) میشود. این التهاب مزمن (گاستریت) نه تنها خود باعث آسیب بافتی میشود، بلکه در زخمهای معده، گسترش گاستریت به تنه معده (Corpus) باعث آتروفی غدد اکسینتیک و کاهش دفاع مخاطی میشود.
۵. پروفایل بالینی: درد، دینامیک تغذیهای و کاهش وزن
تظاهرات بالینی زخم معده دارای الگوهای منحصر به فردی است که ریشه در پاتوفیزیولوژی خاص آن دارد و آن را از سایر بیماریهای پپتیک متمایز میکند.
۵.۱. مکانیسم درد و تشدید با غذا (Food-Provoked Pain)
درد اپیگاستر علامت کلاسیک زخم معده است که اغلب به صورت سوزش یا درد مبهم توصیف میشود. ویژگی بارز زخم معده، الگوی زمانی درد نسبت به وعدههای غذایی است.
بر خلاف زخم دوازدهه که در آن درد با گرسنگی ظاهر شده و با غذا خوردن تسکین مییابد (“Hunger Pain”)، در زخم معده خوردن غذا اغلب باعث تشدید درد میشود. این پدیده دارای مکانیسمهای فیزیولوژیک متعددی است:
- تحریک ترشح اسید (Acid Rebound): اگرچه غذا در ابتدا اسید موجود در معده را رقیق و بافر میکند، اما ورود پروتئینها و اتساع معده محرکهای قوی برای ترشح گاسترین و در نتیجه ترشح اسید تازه هستند. در زخم معده، سد دفاعی مخاطی در محل زخم از بین رفته است؛ بنابراین، افزایش تولید اسید مستقیماً انتهای اعصاب حسی بدون حفاظ در بستر زخم را تحریک میکند.
- پریستالتیسم و اتساع مکانیکی: حضور غذا باعث افزایش حرکات پریستالتیک معده برای مخلوط کردن و تخلیه غذا میشود. انقباضات دیواره ملتهب معده و کشش فیزیکی لبههای زخم ناشی از حجم غذا، گیرندههای مکانیکی درد را در بافت ملتهب فعال کرده و درد احشایی ایجاد میکند.
- ترشح آنزیمها: افزایش ترشح پپسین همزمان با اسید میتواند منجر به هضم پروتئولیتیک بافتهای نکروتیک و زنده در بستر زخم شده و التهاب و درد را تشدید کند.
۵.۲. سیتوفوبیا و کاهش وزن: یک ارتباط سایکوفیزیولوژیک
کاهش وزن در بیماران مبتلا به زخم معده یک یافته شایع و مهم است که مکانیسم آن فراتر از یک بیاشتهایی ساده است.
- سیتوفوبیا (Sitophobia): به معنای “ترس از غذا خوردن” است. بیماران مبتلا به زخم معده به سرعت یاد میگیرند که غذا خوردن منجر به درد میشود. این شرطیسازی باعث میشود بیمار حتی با وجود احساس گرسنگی، از خوردن غذا اجتناب کند یا حجم وعدههای غذایی را به شدت کاهش دهد. نتیجه مستقیم این رفتار، کاهش دریافت کالری و کاهش وزن پیشرونده است.
- سیری زودرس (Early Satiety): التهاب و ادم در اطراف زخم، به ویژه اگر زخم در نزدیکی پیلور یا آنتروم باشد، میتواند اتساعپذیری معده را کاهش دهد یا باعث انسداد نسبی خروجی معده شود. این امر منجر به احساس پری و نفخ بلافاصله پس از شروع غذا خوردن میشود.
۵.۳. مکانیسمهای مولکولی کاشکسی و تنظیم اشتها
در موارد زخمهای مزمن، شدید یا عارضهدار، کاهش وزن ممکن است ناشی از فعالسازی مسیرهای متابولیک و هورمونی سیستمیک باشد.
۵.۳.۱. نقش سیتوکینهای التهابی
التهاب مزمن ناشی از زخم و عفونت H. pylori منجر به افزایش سطح سیتوکینهای پیشالتهابی مانند TNF-α، IL-1β و IL-6 در گردش خون میشود.
- تأثیر بر مغز: این سیتوکینها میتوانند از سد خونی-مغزی عبور کرده و بر هستههای هیپوتالاموس اثر بگذارند. آنها نورونهای اشتهاآور را مهار و نورونهای سرکوبگر اشتها را تحریک میکنند، که نتیجه آن بیاشتهایی است.
- تحلیل عضلانی: TNF-α و IL-6 مسیر یوبیکوئیتین-پروتئازوم را در عضلات اسکلتی فعال میکنند که منجر به تجزیه پروتئینهای عضلانی و تحلیل توده عضلانی (Sarcopenia) میشود.
۵.۳.۲. اختلال در محور گرلین-معده
گرلین یک هورمون پپتیدی است که عمدتاً توسط سلولهای معده تولید میشود و اشتها را تحریک میکند (“هورمون گرسنگی”).
- تأثیر H. pylori بر گرلین: مطالعات نشان دادهاند که عفونت H. pylori، به ویژه زمانی که با آتروفی مخاط معده همراه است، باعث تخریب سلولهای تولیدکننده گرلین و کاهش سطح سرمی گرلین میشود. این کاهش سطح گرلین منجر به کاهش میل به غذا و لاغری میشود.
- پدیده بازگشت وزن: یکی از شواهد تأییدکننده این مکانیسم، افزایش سطح گرلین و بهبود اشتها پس از درمان و ریشهکنی موفق H. pylori است.
۶. تمایز زخمهای خوشخیم از بدخیمیهای معده
یکی از حیاتیترین چالشها در مدیریت زخم معده، اطمینان از عدم وجود سرطان معده (Gastric Adenocarcinoma) یا لنفوم است. سرطان معده میتواند به صورت یک ضایعه زخمی تظاهر کند و علائم و ظاهری فریبنده شبیه به زخم خوشخیم داشته باشد. با توجه به پیشآگهی ضعیف سرطان معده پیشرفته، تشخیص زودهنگام و افتراق دقیق امری ضروری است.
۶.۱. اهمیت بیوپسی و استراتژی نظارت
بر خلاف زخمهای دوازدهه که به ندرت بدخیم هستند، زخمهای معده پتانسیل قابل توجهی برای بدخیمی دارند. نکته بسیار مهم این است که زخمهای بدخیم نیز ممکن است با درمانهای ضداسید (PPI) به طور موقت ترمیم شوند و علائم بیمار بهبود یابد. این “بهبودی کاذب” نباید پزشک را فریب دهد.
پروتکل استاندارد: دستورالعملهای معتبر توصیه میکنند که از تمام زخمهای معده بیوپسی تهیه شود (حداقل ۶-۸ نمونه از لبهها و بستر زخم) و پیگیری اندوسکوپیک تا زمان اثبات بهبودی کامل مخاطی (معمولاً ۸ تا ۱۲ هفته بعد) ادامه یابد.
۶.۲. ویژگیهای مورفولوژیک و اندوسکوپیک افتراقی
اگرچه تشخیص قطعی تنها با پاتولوژی است، برخی ویژگیهای ماکروسکوپیک در اندوسکوپی میتوانند به شدت مطرحکننده بدخیمی باشند. جدول زیر مقایسه دقیقی از این ویژگیها ارائه میدهد:
| ویژگی | زخم خوشخیم | زخم بدخیم | حساسیت و ویژگی آماری بدخیمی |
|---|---|---|---|
| لبههای زخم | منظم، صاف، قرینه، همسطح با مخاط. | نامنظم، دندانهدار، نامتقارن، برجسته و ندولار. | لبه نامنظم: حساسیت ۹۱٪، ویژگی ۸۹٪. |
| بستر زخم | تمیز، هموار، پوشیده از اگزودای سفید-زرد یکنواخت. | کثیف، ناهموار، ندولار، دارای رنگهای غیرعادی، بافت نکروتیک. | بستر کثیف: حساسیت ۷۹٪، ویژگی ۹۳٪. |
| چینهای مخاطی | چینها به سمت مرکز زخم همگرا میشوند و نازک میشوند. | چینها ناگهان قطع میشوند، ضخیم و چماقی یا ادغام شده هستند. | قطع ناگهانی یا ظاهر پروانهای بسیار مشکوک است. |
| اندازه | معمولاً کوچک (کمتر از ۱ تا ۲ سانتیمتر). | معمولاً بزرگ (بیش از ۲ تا ۳ سانتیمتر). | ۸۶٪ زخمهای بزرگتر از ۳ سانتیمتر بدخیم هستند. |
| قوام بافت | نرم و قابل انعطاف. | سفت، سخت و ایندوره. | سفتی ناشی از بافت فیبروز تومورال است. |
| موقعیت | بیشتر در محل اتصال آنتروم و بدنه. | میتواند در هر جایی باشد، اما بدنه فوقانی و کاردیا مشکوکترند. | – |
۶.۳. سیستمهای طبقهبندی و مرحلهبندی زخمها
برای استانداردسازی گزارشهای اندوسکوپی و پیگیری روند درمان، از سیستمهای طبقهبندی دقیق استفاده میشود.
۶.۳.۱. طبقهبندی ساکیتا-میوا (Sakita-Miwa Classification)
این سیستم برای توصیف مراحل بهبودی زخمهای خوشخیم استفاده میشود:
- مرحله فعال (Active Stage): A1 (لایه ضخیم سفید، ادم شدید)، A2 (کاهش ادم، لبههای واضحتر).
- مرحله بهبودی (Healing Stage): H1 (نازک شدن لایه سفید، پیشروی اپیتلیوم)، H2 (نقص کوچک، پوشش اپیتلیال وسیع).
- مرحله اسکار (Scarring Stage): S1 (اسکار قرمز)، S2 (اسکار سفید – هدف نهایی).
۶.۳.۲. طبقهبندی بورمن (Borrmann Classification)
این سیستم برای طبقهبندی ماکروسکوپیک سرطانهای پیشرفته معده استفاده میشود:
- Type I (Polypoid): توده پولیپوئید.
- Type II (Ulcerated with defined margins): توده زخمی با لبههای مشخص.
- Type III (Ulcerated with infiltrative margins): توده زخمی با لبههای نامشخص و نفوذی (شایعترین).
- Type IV (Diffusely Infiltrative): سرطان منتشر (Linitis Plastica).
۶.۳.۳. طبقهبندی پاریس (Paris Classification)
این سیستم برای ضایعات سطحی و سرطانهای زودرس معده (EGC) استفاده میشود. Type 0-III (Excavated) دقیقاً شبیه زخم پپتیک به نظر میرسد و افتراق آن بسیار چالشبرانگیز است.
۷. نتیجهگیری و چشمانداز
زخم معده یک بیماری چندوجهی است که ریشه در شکست مکانیسمهای دفاعی پیچیده مخاطی دارد. تعامل بین فاکتورهای ویرولانس H. pylori (مانند CagA و VacA) که اتصالات سلولی را هدف قرار میدهند، و مکانیسمهای بیوشیمیایی NSAIDها (به دام افتادن یون و مهار COX-1)، منجر به آسیب بافتی گسترده میشود. تظاهرات بالینی، بهویژه الگوی درد تشدید شونده با غذا و کاهش وزن مرتبط با سیتوفوبیا و تغییرات هورمونی (گرلین)، پروفایل متمایزی برای این بیماری ترسیم میکند.
در مدیریت بالینی، تمایز این زخمها از بدخیمیهای معده اولویت مطلق دارد. استفاده هوشمندانه از نشانههای مورفولوژیک (مانند حاشیه نامنظم و بستر کثیف) در کنار سیستمهای طبقهبندی استاندارد (ساکیتا و بورمن) و پایبندی به پروتکلهای نمونهبرداری و پیگیری، تنها راه تضمین ایمنی بیمار و تشخیص زودهنگام سرطانهای پنهان در پسِ نقابِ زخم است.
بازبینی توسط متخصص
بازبین علمی این مقاله
آیا سابقه سرطان معده یا زخمهای مقاوم به درمان در خانواده دارید؟
تشخیص زودهنگام و افتراق صحیح زخمهای خوشخیم از بدخیم حیاتی است. اگر در خانواده سابقه سرطان معده دارید یا با زخمهای عودکننده مواجه هستید، تیم ما آماده ارائه مشاوره ژنتیک و پزشکی تخصصی است.
دریافت مشاوره ژنتیک