افقهای نوین در ژندرمانی کوررنگی
بازسازی سلولهای مخروطی و پلاستیسیته عصبی
تحول در حوزه چشمپزشکی و ژنتیک مولکولی در سالهای ۲۰۲۴ و ۲۰۲۵، چشمانداز درمان بیماریهای ارثی شبکیه (IRDs) را از مدیریت علائم به سمت اصلاح ریشهای ژنتیکی تغییر داده است. برای دههها، نقص در تشخیص رنگها یا کوری کامل رنگ (Achromatopsia) به عنوان ناتوانیهای ایستا و غیرقابل درمان شناخته میشدند که ناشی از نقص در معماری گیرندههای نوری مخروطی بودند. با این حال، دادههای حاصل از تحقیقات اخیر بر روی پریماتها و نتایج اولیه کارآزماییهای بالینی انسانی نشان میدهد که با استفاده از تکنولوژیهای پیشرفتهای نظیر ویرایش ژنوم کریسپر (CRISPR) و انتقال ژن توسط ناقلهای ویروسی مرتبط با آدنو (AAV)، میتوان سلولهای مخروطی غیرفعال را بازسازی کرده و پلاستیسیته مغز را برای تفسیر سیگنالهای رنگی جدید تحریک نمود. این گزارش تحلیلی به بررسی دقیق مکانیسمهای مولکولی، پیشرفتهای بالینی و چالشهای اقتصادی-صنعتی در مسیر بازگرداندن رنگها به دنیای افراد کوررنگ میپردازد.
مبانی بیولوژیکی و پاتوفیزیولوژی نقص عملکرد مخروطی
سیستم بینایی انسان بر دو نوع گیرنده نوری اصلی در شبکیه تکیه دارد: سلولهای استوانهای (Rods) که مسئول بینایی در شب و نور کم هستند، و سلولهای مخروطی (Cones) که مسئول بینایی در روز و تشخیص رنگها میباشند. شبکیه انسان حاوی حدود ۴ تا ۶ میلیون سلول مخروطی است که در ناحیه مرکزی فوییا (Fovea) متمرکز شدهاند. این سلولها به سه دسته اصلی تقسیم میشوند: مخروطیهای با طول موج بلند (L) برای رنگ قرمز، طول موج متوسط (M) برای رنگ سبز و طول موج کوتاه (S) برای رنگ آبی.
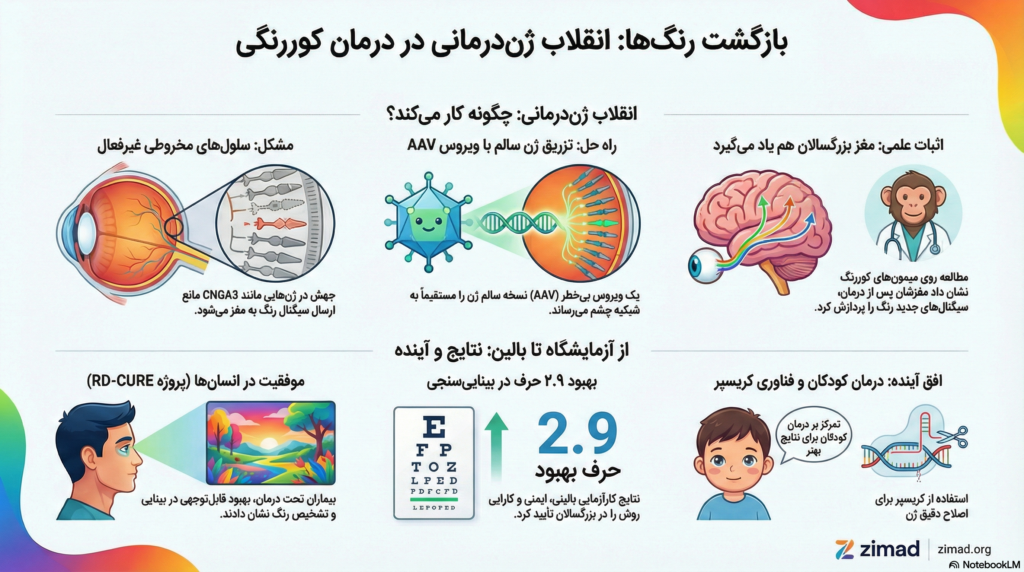
نقص در هر یک از این دستهها منجر به انواع مختلف کوررنگی میشود. شایعترین شکل آن، کوررنگی قرمز-سبز است که به دلیل جهش در لوکوس ژنی OPN1LW یا OPN1MW بر روی کروموزوم X رخ میدهد. در موارد شدیدتر مانند آکروماتوپسی (Achromatopsia)، فرد فاقد هرگونه عملکرد مخروطی است که منجر به کوری کامل رنگ، حساسیت شدید به نور (Photophobia) و کاهش شدید قدرت بینایی میشود.
ژنتیک مولکولی و کانالهای CNG
بخش بزرگی از موارد آکروماتوپسی (حدود ۷۰ تا ۸۰ درصد) ناشی از جهش در ژنهای CNGA3 و CNGB3 است. این ژنها زیرواحدهای کانالهای کاتیونی وابسته به نوکلئوتید حلقوی (CNG) را کدگذاری میکنند که برای انتقال سیگنال نوری (Phototransduction) در سلولهای مخروطی حیاتی هستند. فرآیند بینایی با جذب فوتون توسط اپسینها آغاز شده و منجر به تغییر در سطح cGMP میشود که در نهایت باز و بسته شدن کانالهای CNG و تغییر پتانسیل الکتریکی سلول را به همراه دارد. در بیماران مبتلا به جهشهای CNGA3 یا CNGB3، این کانالها به درستی عمل نکرده و سلولهای مخروطی علیرغم حضور فیزیکی، قادر به ارسال سیگنال به مغز نیستند.
| ژن هدف | پروتئین کدگذاری شده | نوع اختلال | وضعیت درمانی (۲۰۲۵) |
|---|---|---|---|
| CNGA3 | زیرواحد آلفا کانال CNG | آکروماتوپسی تیپ ۲ | فاز ۲ کارآزمایی بالینی |
| CNGB3 | زیرواحد بتا کانال CNG | آکروماتوپسی تیپ ۳ | فاز ۱/۲ کارآزمایی بالینی |
| OPN1LW | اپسین طول موج بلند (قرمز) | پروتانوپیا / BCM | تحقیقات پریمات و مدل موش |
| OPN1MW | اپسین طول موج متوسط (سبز) | دوترانوپیا / BCM | مدلهای حیوانی |
| PDE6C | فسفودیاستراز مخروطی | آکروماتوپسی تیپ ۵ | مراحل پیشبالینی |
پیشرفتهای تکنولوژیک در ناقلهای ویروسی و ترابری ژنی
موفقیت در ژندرمانی چشمی به شدت به کارایی ناقلهای ویروسی در رساندن محموله ژنتیکی به سلولهای هدف بستگی دارد. ویروسهای مرتبط با آدنو (AAV) به دلیل ایمنیزایی پایین و توانایی ایجاد بیان پایدار ژن در سلولهای غیرقابل تقسیم، به عنوان استاندارد طلایی در این حوزه شناخته میشوند.
مهندسی کپسید و گزینشپذیری سلولی
تحقیقات در سال ۲۰۲۴ و ۲۰۲۵ بر بهینهسازی کپسیدهای AAV متمرکز شده است تا از موانع فیزیکی چشم عبور کرده و مستقیماً به سلولهای مخروطی در لایههای بیرونی شبکیه برسند. استفاده از سروتیپهای خاص مانند AAV8 و AAV5 در تزریقهای زیرشبکیهای (Subretinal) نتایج موفقی در هدف قرار دادن فوتورسپتورها نشان داده است. علاوه بر این، نسل جدیدی از کپسیدهای مصنوعی مانند AAVv128 و 7m8 با استفاده از تکامل هدایتشده (Directed Evolution) در پریماتها توسعه یافتهاند که اجازه میدهند از طریق تزریق داخل زجاجیهای (Intravitreal) – که بسیار کمتهاجمیتر از جراحی زیرشبکیهای است – به سلولهای مخروطی دسترسی پیدا کرد.
پروموترهای اختصاصی مخروطی
برای اطمینان از اینکه ژن درمانی تنها در سلولهای مخروطی بیان میشود و نه در سلولهای استوانهای یا سایر لایههای عصبی، دانشمندان از پروموترهای اختصاصی استفاده میکنند. پروموتر PR1.7 که نسخهای کوتاه شده از پروموتر اپسین قرمز انسانی است، در مطالعات پریماتها کارایی بسیار بالایی در ایجاد بیان اختصاصی و قوی در تمام انواع سلولهای مخروطی نشان داده است. انتخاب دقیق این عناصر کنترلی برای جلوگیری از اثرات ناخواسته خارج از هدف (Off-target) و حفظ یکپارچگی عملکردی شبکیه ضروری است.
انقلاب کریسپر در درمان بیماریهای ارثی شبکیه
اگرچه جایگزینی ژن (Gene Augmentation) برای بیماریهای مغلوب که ناشی از فقدان عملکرد پروتئین هستند بسیار موثر است، اما ویرایش ژنوم با استفاده از کریسپر (CRISPR/Cas9) افقهای جدیدی را برای اصلاح مستقیم جهشهای ژنتیکی در سطح DNA گشوده است.
ویرایش دقیق و اصلاح جهش
تکنولوژی کریسپر در سالهای اخیر از برشهای ساده DNA به سمت روشهای دقیقتری مانند “ویرایش باز” (Base Editing) و “ویرایش پرایم” (Prime Editing) حرکت کرده است. ویرایش باز اجازه میدهد تا یک نوکلئوتید خاص بدون ایجاد شکست در هر دو رشته DNA تغییر یابد، که ریسک خطاهای ناخواسته را به شدت کاهش میدهد. در سال ۲۰۲۴، مطالعات بر روی مدلهای حیوانی نشان داد که ویرایش باز میتواند تا ۶۰ درصد واریانتهای ژنتیکی را در سلولهای هدف اصلاح کند.
در حوزه چشم، کارآزمایی بالینی EDIT-101 اولین تلاش جهانی برای استفاده مستقیم از کریسپر در بدن انسان بود که هدف آن حذف جهش در ژن CEP290 در بیماران مبتلا به LCA10 بود. نتایج اولیه نشان داد که این روش در ۶۴ درصد بیماران منجر به بهبود حرکت در نور کم و حساسیت بصری شده است. این موفقیت راه را برای استفاده از کریسپر در درمان انواع دیگر کوررنگی و آکروماتوپسی هموار کرده است.
بازگشت رنگها در پریماتها: مطالعه جِی نیتز و چالش دوره بحرانی
یکی از مهمترین نقاط عطف در تاریخ تحقیقات کوررنگی، مطالعهای است که توسط دکتر جِی نیتز در دانشگاه واشینگتن انجام شد. این تحقیق ثابت کرد که سیستم بینایی پریماتها پلاستیسیته فوقالعادهای دارد و میتواند در سنین بزرگسالی نیز سیگنالهای رنگی جدید را پردازش کند.
آزمایش روی میمونهای سنجابی
میمونهای سنجابی نر به طور طبیعی دچار کوررنگی قرمز-سبز هستند (Dichromats). تیم دکتر نیتز با تزریق زیرشبکیهای یک ناقل AAV حاوی ژن اپسین L انسانی به چشم دو میمون نر بزرگسال، تلاش کردند تا مخروطیهای حساس به طول موج بلند را فعال کنند. حدود ۲۰ هفته پس از تزریق، میمونها که قبلاً در تستهای کامپیوتری قادر به تشخیص نقاط رنگی در پسزمینه خاکستری نبودند، شروع به گذراندن موفقیتآمیز تستها کردند.
این یافته از آن جهت انقلابی بود که باور قدیمی “دوره بحرانی” را به چالش کشید. پیش از این تصور میشد که اگر مغز در دوران کودکی با سیگنالهای رنگی مواجه نشود، مدارهای عصبی لازم برای درک رنگ هرگز شکل نخواهند گرفت. موفقیت در میمونهای بزرگسال نشان داد که مدارهای عصبی “مخالفخوان” (Opponent circuits) که مسئول مقایسه سیگنالهای مخروطی هستند، احتمالاً در بدو تولد وجود دارند یا آنقدر انعطافپذیرند که با دریافت ورودیهای جدید، شروع به کار کنند.
پیامدها برای درمان انسان
موفقیت در پریماتها امیدهای زیادی را برای درمان کوررنگی در انسانهای بزرگسال ایجاد کرد. با این حال، تفاوتهای جزیی در دستهبندی رنگها بین انسان و ماکاکها مشاهده شده است. برای مثال، تحقیقات سال ۲۰۲۵ نشان داد که در حالی که انسانها دستهبندیهای واضحی برای صورتی، نارنجی و سبز دارند، پریماتهای تحت درمان ممکن است تعصبات حافظه رنگی متفاوتی نشان دهند که نشاندهنده نقش عوامل یادگیری و زبان در تکامل کامل ادراک رنگ است.
کارآزماییهای بالینی انسانی و پروژه RD-CURE
پروژه RD-CURE که حاصل همکاری دانشگاههای توبینگن و مونیخ (LMU) در آلمان است، پیشرو در انتقال ژندرمانی آکروماتوپسی از آزمایشگاه به بالین بوده است.
ایمنی و کارایی در بیماران بزرگسال
در اولین مطالعه بالینی (NCT02610582)، نه بیمار بزرگسال مبتلا به آکروماتوپسی ناشی از جهش CNGA3 تحت درمان با ناقل AAV8.hCNGA3 قرار گرفتند. نتایج منتشر شده در JAMA Ophthalmology تایید کرد که این روش در انسان ایمن است و هیچ عارضه جانبی جدی مرتبط با دارو مشاهده نشده است.
از نظر کارایی، علیرغم اینکه شبکیه بیماران بزرگسال به دلیل دههها عدم فعالیت دچار آسیبهای ساختاری شده بود، بهبودهای معناداری در حدت بینایی (متوسط ۲.۹ حرف)، حساسیت به کنتراست و تشخیص رنگ مشاهده شد. این نتایج ثابت کرد که فعالسازی مخروطیها حتی در سیستمهای بینایی که هرگز رنگ را تجربه نکردهاند، امکانپذیر است.
تمرکز بر درمان کودکان در سال ۲۰۲۶
محققان بر این باورند که بهترین نتایج در کودکان حاصل خواهد شد، زیرا شبکیه آنها سلولهای زنده بیشتری دارد و مغز آنها در اوج پلاستیسیته برای یادگیری پردازش رنگ قرار دارد. تاییدیه بودجه برای مطالعات پیگیری در سال ۲۰۲۶ جهت درمان کودکان و استفاده از ناقل در هر دو چشم، گام بزرگی به سوی درمان قطعی آکروماتوپسی محسوب میشود.
| شاخص | مقدار / نتیجه | اهمیت بالینی |
|---|---|---|
| تعداد شرکتکنندگان | ۹ بیمار (۲۴ تا ۵۹ سال) | اثبات ایمنی در سنین مختلف |
| دوز تزریقی | 1×1010 تا 1×1011 ژنوم | تعیین دوز بهینه برای فازهای بعدی |
| تغییر در حدت بینایی | +۲.۹ حرف (P=0.006) | بهبود آماری معنادار در بینایی مرکزی |
| وضعیت ایمنی | بدون تغییر دائمی در ساختار شبکیه | تایید غیرسمی بودن ناقل AAV8 |
| پایداری نتایج | تداوم تا ۳ سال پس از تزریق | نشاندهنده بیان طولانیمدت ترانسژن |
استراتژیهای “مستقل از ژن” و بازفعالسازی مخروطیهای خفته
در حالی که بسیاری از درمانها بر اصلاح یک ژن خاص متمرکز هستند، برخی شرکتهای بیوتکنولوژی مانند SparingVision بر روی روشهای “مستقل از جهش” (Mutation-agnostic) کار میکنند که میتواند طیف وسیعتری از بیماران را درمان کند.
تکنولوژی SPVN20 و کانالهای GIRK
در مراحل پیشرفته بیماریهای ارثی شبکیه، سلولهای مخروطی ممکن است توانایی تشخیص نور را از دست بدهند اما همچنان زنده باقی بمانند که به آنها “مخروطیهای خفته” (Dormant cones) گفته میشود. درمان SPVN20 با تحویل ژن کانال پتاسیم GIRK به این سلولها، به آنها اجازه میدهد تا مجدداً سیگنالهای نوری را به پالسهای الکتریکی تبدیل کنند.
این رویکرد که در سال ۲۰۲۵ وارد فاز اول کارآزمایی بالینی (NYRVANA) شد، پتانسیل بازگرداندن بینایی با وضوح بالا و ادراک رنگ را در بیمارانی دارد که در مراحل نهایی نابینایی هستند. برخلاف اپتوژنتیک سنتی که از پروتئینهای بیگانه در لایههای دیگر شبکیه استفاده میکند، SPVN20 مستقیماً مدار فیزیولوژیک موجود را در سطح مخروطیها بازسازی میکند که منجر به بینایی طبیعیتر میشود.
پردازش مغزی و پلاستیسیته عصبی پس از ژندرمانی
پرسش بنیادین این است که چگونه مغز سیگنالهای جدید را تفسیر میکند؟ تحقیقات سال ۲۰۲۵ نشان میدهد که مغز پریماتها دارای الگوریتمهای درونی پیچیدهای برای “گرافیک معکوس” است که تصاویر ۲ بعدی شبکیه را به مدلهای ذهنی ۳ بعدی تبدیل میکند.
یادگیری خودنظارتی در قشر بینایی
مدلهای محاسباتی جدید پیشنهاد میکنند که قشر بینایی میتواند از نوسانات سیگنالهای عصب بینایی تحت حرکات طبیعی چشم برای استنباط ابعاد رنگ استفاده کند. این مدلها با موفقیت شبیهسازی کردند که چگونه پس از ژندرمانی در میمونهای سنجابی، مغز توانسته است ابعاد رنگ را از ۲ بعد به ۳ بعد افزایش دهد. این پلاستیسیته عصبی حتی در بزرگسالان نیز وجود دارد، هرچند سرعت و عمق آن ممکن است کمتر از کودکان باشد.
یافتههای حاصل از تصویربرداری fMRI در بیماران تحت درمان آکروماتوپسی نشان داده است که پس از فعالسازی مخروطیها، مسیرهای بصری جدیدی در مغز شکل میگیرد که با سیگنالهای تازه سازگار میشوند. این موضوع نشان میدهد که ژندرمانی تنها نیمی از راه است و نیم دیگر آن، فرآیند یادگیری مغز برای درک دنیای جدید و رنگارنگ است.
چالشهای اقتصادی، تولیدی و دسترسی جهانی
علیرغم پیشرفتهای علمی خیرهکننده، هزینه تولید و قیمت نهایی ژندرمانیها یکی از بزرگترین موانع برای دسترسی همگانی است.
هزینههای سرسامآور و مدلهای اقتصادی
ژندرمانیهایی مانند Luxturna که برای نوع دیگری از نابینایی ارثی تایید شده است، حدود ۸۵۰,۰۰۰ دلار برای هر دو چشم هزینه دارد. داروهایی مانند Zolgensma نیز به قیمت ۲.۱ میلیون دلار فروخته میشوند. اگرچه این مبالغ نجومی به نظر میرسند، اما تحلیلهای سال ۲۰۲۵ نشان میدهند که با توجه به “یکبار مصرف” بودن این درمانها و حذف هزینههای مراقبتی مادامالعمر، پتانسیل سودآوری اقتصادی در بلندمدت وجود دارد.
| نام محصول / دسته | هزینه تخمینی (دلار) | وضعیت تایید / بازار | منبع |
|---|---|---|---|
| Luxturna | ۸۵۰,۰۰۰ | تایید شده (FDA/EMA) | – |
| Nanoscope (MCO-010) | ۶۷,۴۰۰ – ۱۰۱,۳۰۰ | فاز ۳ کارآزمایی بالینی | – |
| Zolgensma | ۲,۱۰۰,۰۰۰ | تایید شده (بیماریهای دیگر) | – |
| بازار جهانی ۲۰۳۰ | ۳۰+ میلیارد دلار | پیشبینی رشد سالانه ۲۶.۵٪ | – |
گلوگاههای تولید و پایداری محصول
تولید ناقلهای AAV در مقیاس صنعتی با چالشهایی نظیر “کپسیدهای خالی” روبروست که منجر به افزایش هزینه و ریسک پاسخهای ایمنی میشود. همچنین، پایداری طولانیمدت این ویروسهای حساس در زنجیره توزیع جهانی نیازمند تکنولوژیهای جدیدی مانند لیوفیلیزاسیون (خشک کردن انجمادی) است تا بتوان آنها را در دمای یخچال معمولی و نه در فریزرهای فوقسرد نگهداری کرد.
چشمانداز آینده: درمانهای ترکیبی و ویرایش شخصیسازی شده
در سالهای ۲۰۲۶ و پس از آن، انتظار میرود که ژندرمانی کوررنگی به سمت رویکردهای ترکیبی حرکت کند. این شامل ترکیب جایگزینی ژن با داروهای محافظتکننده عصبی (Neuroprotective) برای جلوگیری از تخریب بیشتر شبکیه است.
علاوه بر این، استفاده از هوش مصنوعی در طراحی کپسیدهای AAV اجازه میدهد تا ناقلهایی با هدفگیری دقیقتر و تحریک ایمنی کمتر ساخته شوند. ظهور “ویرایش پرایم” نیز پتانسیل اصلاح تقریباً هر نوع جهش نقطهای را به صورت شخصیسازی شده فراهم میکند که میتواند برای واریانتهای نادر کوررنگی بسیار ارزشمند باشد.
توسعه روشهای تحویل جدید مانند تزریقهای فوقمشیمیه (Suprachoroidal) که در مطب پزشک و بدون نیاز به جراحی پیچیده قابل انجام است، میتواند دسترسی بیماران را به این درمانهای پیشرفته به طور چشمگیری افزایش دهد.
نتیجهگیری و توصیههای بالینی
تحقیقات سالهای ۲۰۲۴ و ۲۰۲۵ تایید کردهاند که کوررنگی و آکروماتوپسی دیگر شرایط غیرقابل تغییر نیستند. موفقیتهای بهدستآمده در پریماتها و کارآزماییهای بالینی اولیه انسانی در آلمان و ایالات متحده نشان میدهد که بازگرداندن عملکرد به سلولهای مخروطی از نظر بیولوژیکی امکانپذیر است و مغز انسان پلاستیسیته لازم برای پردازش این اطلاعات جدید را داراست.
نکات کلیدی برای آینده این حوزه عبارتند از:
- ۱. مداخله زودهنگام: درمان در دوران کودکی به دلیل حفظ ساختار شبکیه و پلاستیسیته بالاتر مغز، نتایج به مراتب بهتری نسبت به بزرگسالی خواهد داشت.
- ۲. تست ژنتیک: شناسایی دقیق جهش (مثلاً CNGA3 در مقابل CNGB3) برای انتخاب پروتوکول درمانی صحیح حیاتی است.
- ۳. رویکردهای مستقل از ژن: برای بیماران در مراحل پیشرفته، تکنولوژیهایی مانند SPVN20 که مخروطیهای خفته را هدف قرار میدهند، امیدبخشترین گزینه هستند.
با ادامه روند فعلی و ورود درمانهای جدید به فاز ۳ کارآزماییهای بالینی، انتظار میرود در نیمه دوم دهه ۲۰۲۰، دنیای رنگها برای میلیونها انسان که در فضای خاکستری زندگی میکنند، در دسترس قرار گیرد. این تحول علمی نه تنها کیفیت زندگی بیماران را بهبود میبخشد، بلکه درک ما را از نحوه تعامل ژنها، سلولهای حسی و قدرت یادگیری مغز انسان به طور بنیادین تغییر خواهد داد.
بازبینی توسط متخصص
بازبین علمی این مقاله
آیا کوررنگی در خانواده شما ارثی است؟
با توجه به پیشرفتهای شگفتانگیز در ژندرمانی، شناسایی دقیق نوع ژنتیکی کوررنگی (مانند جهشهای CNGA3 یا CNGB3) میتواند کلید دسترسی به درمانهای آینده باشد.
دریافت مشاوره ژنتیک