معماری ژنتیکی تعیین جنسیت و کشف واریانتهای نوین آلوموزومی
تحلیل جامع دادههای مطالعه All of Us در سال ۲۰۲۴
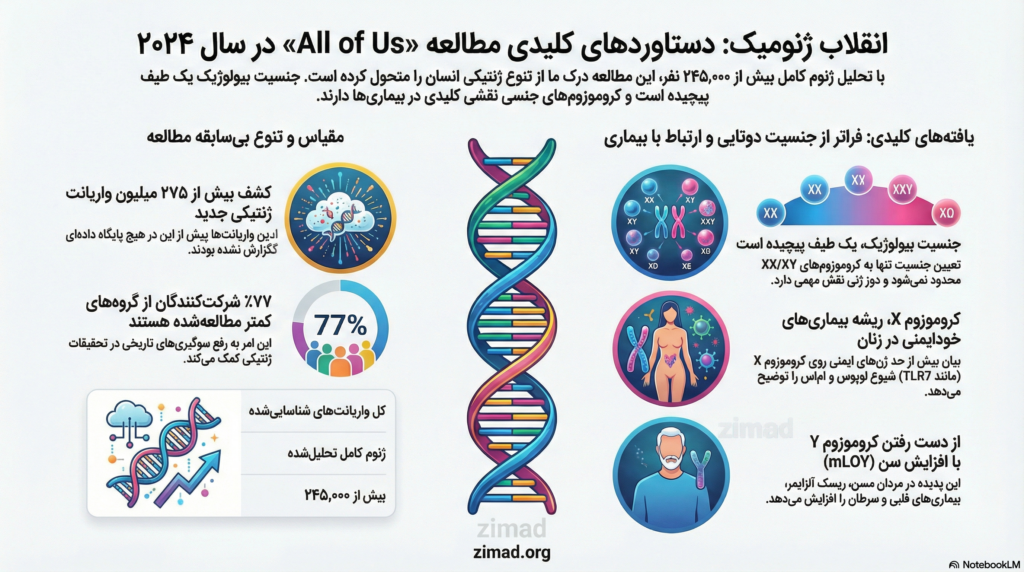
چشمانداز ژنتیک انسانی با انتشار دادههای برنامه پژوهشی “All of Us” در سال ۲۰۲۴ توسط مؤسسات ملی بهداشت (NIH)، دستخوش یک دگرگونی بنیادین شده است. این ابتکار عظیم که با هدف ثبت دادههای ژنومیک و سلامت یک میلیون نفر در ایالات متحده طراحی شده، در آخرین گزارش خود به تجزیه و تحلیل توالی ژنوم کامل بیش از ۲۴۵,۰۰۰ شرکتکننده پرداخته است. کشف بیش از ۲۷۵ میلیون واریانت ژنتیکی جدید که پیش از این هرگز گزارش نشده بودند، نه تنها درک دانشمندان از تنوع انسانی را گسترش داده، بلکه مفاهیم سنتی تعیین جنسیت بیولوژیک و ریشههای ژنتیکی بیماریهای پیچیده، بهویژه اختلالات خودایمنی و عصبی-روانی را با چالشهای جدی مواجه کرده است. تمرکز ویژه این گزارش بر آلوموزومها یا کروموزومهای جنسی (X و Y)، پرده از پیچیدگیهایی برمیدارد که نشان میدهند جنسیت بیولوژیک بیش از آنکه یک متغیر دوتایی ساده باشد، نتیجه تعاملات دوز ژنی، مکانیسمهای اپیژنتیک و پدیدههای موزائیسم سوماتیک است.
انقلاب در مقیاس و تنوع دادههای ژنومیک
یکی از برجستهترین ویژگیهای مطالعه ۲۰۲۴، فراتر رفتن از محدودیتهای تاریخی در پژوهشهای ژنتیکی است. در دهههای گذشته، بیش از ۸۰ درصد دادههای ژنومیک جهانی از افراد با تبار اروپایی استخراج میشد که منجر به سوگیری در تشخیص بیماریها و توسعه داروها میگشت. مطالعه All of Us با رویکردی متفاوت، موفق شده است ۷۷ درصد از شرکتکنندگان خود را از جوامعی جذب کند که از نظر تاریخی در تحقیقات زیستفناوری نادیده گرفته شدهاند. این تنوع بیسابقه، امکان شناسایی واریانتهایی را فراهم کرده است که تنها در جمعیتهای خاصی با تبار آفریقایی، آسیایی یا آمریکای لاتین دیده میشوند.
تجزیه و تحلیل بیش از یک میلیارد واریانت ژنتیکی، شامل واریانتهای تکنوکلئوتیدی (SNV)، درج و حذفهای کوچک (Indel) و واریانتهای ساختاری (SV)، نشاندهنده ظرفیت عظیم این پایگاه داده برای بازتعریف پزشکی دقیق است. استفاده از فناوریهای توالییابی طولانیخوان (Long-read sequencing) در کنار روشهای استاندارد، اجازه داده است تا مناطقی از ژنوم که پیش از این به دلیل پیچیدگیهای ساختاری “تاریک” تلقی میشدند، با دقت بالا نقشهبرداری شوند.
| ویژگی دادههای ژنومیک All of Us 2024 | مقادیر و آمار گزارش شده |
|---|---|
| تعداد کل واریانتهای ژنتیکی شناسایی شده | بیش از ۱ میلیارد |
| تعداد واریانتهای جدید (گزارش نشده در گذشته) | بیش از ۲۷۵ میلیون |
| تعداد واریانتهای دارای پیامد کدکننده پروتئین | بیش از ۳.۹ میلیون |
| درصد شرکتکنندگان از گروههای تحتنمایندگی | ۷۷ درصد |
| تعداد توالیهای ژنوم کامل با گرید بالینی | ۲۴۵,۳۸۸ مورد |
تعیین جنسیت بیولوژیک: عبور از پارادایم دوتایی
موضوع “تغییر جنسیت ژنتیکی” یا به عبارت دقیقتر، وجود طیفی از تظاهرات جنسی که با مدل سنتی XX (ماده) و XY (نر) همخوانی ندارند، یکی از محورهای اصلی تحلیلهای اخیر است. تعیین جنسیت در پستانداران و انسان یک فرایند چندمرحلهای و پیچیده است که از لحظه لقاح آغاز شده و در طول رشد جنینی و بلوغ ادامه مییابد. اگرچه حضور کروموزوم Y و ژن SRY به طور معمول منجر به تشکیل بیضهها میشود، اما دادههای جدید نشان میدهند که دهها ژن دیگر بر روی کروموزومهای اتوزوم و X در هدایت این مسیر نقش دارند.
مکانیسمهای مولکولی و دوز ژنی
تفاوتهای جنسی در پستانداران از تفاوتهای مولکولی کدگذاری شده توسط کروموزومهای X و Y منشأ میگیرند. در زنان (XX)، یکی از کروموزومهای X در اوایل تکامل غیرفعال میشود تا تعادل دوز ژنی با مردان (XY) برقرار گردد. با این حال، شواهد نشان میدهند که حدود ۱۵ تا ۲۳ درصد از ژنهای کروموزوم X از این فرایند غیرفعالسازی فرار میکنند (X-inactivation escape). این فرار منجر به بیان دوز بالاتری از برخی ژنها در زنان میشود که میتواند توضیحی برای تفاوتهای فیزیولوژیک و تمایل به بیماریهای خاص باشد.
مطالعات All of Us نشان میدهند که مناطقی موسوم به نواحی شبهاتوزومی (Pseudoautosomal Regions – PAR1 & PAR2) در انتهای کروموزومهای X و Y، حاوی ژنهایی هستند که در هر دو جنس به طور فعال بیان میشوند. ژن SHOX در ناحیه PAR1 یکی از این موارد است که نقش حیاتی در تعیین قد انسان ایفا میکند. تحلیل دادههای نزدیک به یک میلیون نفر نشان داد که افزایش دوز کروموزوم Y نسبت به کروموزوم X غیرفعال (Xi)، تأثیر بیشتری بر افزایش قد دارد.
| عامل ژنتیکی/هورمونی | تأثیر بر قد (سانتیمتر) | فاصله اطمینان ۹۵٪ |
|---|---|---|
| افزایش دوز کروموزوم Y | +۳.۱ | [۱.۹, ۴.۳] |
| دوز کروموزوم X غیرفعال (Xi) | مثبت (کمتر از Y) | گزارش نشده |
| حضور هورمونهای جنسی مردانه | معنادار | N/A |
این یافتهها تأیید میکنند که تفاوتهای فیزیکی بین دو جنس تنها ناشی از هورمونها نیست، بلکه ناشی از نابرابری در بیان ژنهای نواحی PAR است که به طور ناقص در کروموزوم X غیرفعال خاموش میشوند. این مکانیسم دوز ژنی، توضیحی بیولوژیک برای قد بلندتر در افراد با آنوپلوئیدیهای کروموزوم جنسی مانند 47,XYY و 47,XXY فراهم میکند.
آنوپلوئیدیهای کروموزوم جنسی (SCA) و تنوع فنوتیپی
دادههای All of Us شیوع قابل توجهی از آنوپلوئیدیهای کروموزوم جنسی را ثبت کردهاند که از مدلهای معمول XX/XY فراتر میروند. این شرایط شامل سندرم کلاینفلتر (47,XXY)، سندرم ترنر (45,X)، سندرم تریپل ایکس (47,XXX) و سندرم جاکوبز (47,XYY) است. این افراد نه تنها درک ما از مرزهای جنسی را گسترش میدهند، بلکه به عنوان مدلهای ارزشمندی برای مطالعه اثرات دوز ژنی بر سلامت روان و بیماریهای مزمن عمل میکنند.
برای مثال، در حوزه اختلال طیف اتیسم (ASD)، که به طور سنتی در مردان چهار برابر شایعتر است، بررسی دوز کروموزومهای جنسی در کوهورتهای بزرگ All of Us و SPARK نشان داد که حضور کروموزوم Y اضافی به طور معناداری خطر اتیسم را بیش از کروموزوم X اضافی افزایش میدهد. این پدیده موسوم به “اثر Y اضافی”، فرضیه قدیمی “اثر محافظتی زنانه” را به چالش میکشد و نشان میدهد که عوامل مستقیمی روی کروموزوم Y ممکن است آسیبپذیری عصبی-تکاملی را افزایش دهند.
واریانتهای نوین و بیماریهای خودایمنی: پیوند کروموزوم X
یکی از حیاتیترین یافتههای مطالعه ۲۰۲۴، تبیین رابطه بین واریانتهای کروموزوم جنسی و شیوع بالای بیماریهای خودایمنی در زنان است. بیماریهایی مانند لوپوس اریتماتوز سیستمیک (SLE)، اماس (MS) و آرتریت روماتوئید، تفاوت جنسی فاحشی را نشان میدهند.
فرار از غیرفعالسازی و بیان بیش از حد ژنهای ایمنی
بسیاری از ژنهای کلیدی سیستم ایمنی بر روی کروموزوم X قرار دارند. به عنوان مثال، ژن TLR7 که مسئول شناسایی RNA ویروسی و تحریک پاسخ اینترفرون است، بر روی کروموزوم X واقع شده و در برخی زنان از فرایند غیرفعالسازی فرار میکند. دوز مضاعف این ژن در سلولهای ایمنی زنان میتواند آستانه تحریک سیستم ایمنی را کاهش داده و منجر به حمله به خودی شود.
مطالعه All of Us با شناسایی میلیونها واریانت جدید در مناطق تنظیمی کروموزوم X، نشان داد که برخی واریانتهای نادر میتوانند میزان فرار از غیرفعالسازی را در افراد مختلف تغییر دهند. در تحقیقی بر روی ۳۰۱ مادر مبتلا به روانپریشی پس از زایمان (که یک وضعیت با مولفه ایمنی-هورمونی قوی است)، مشخص شد که واریانتهای کروموزوم X حدود ۱۴.۲ درصد از وراثتپذیری این اختلال را توضیح میدهند که بسیار فراتر از انتظار بر اساس اندازه فیزیکی این کروموزوم است.
واریانتهای ساختاری و خطر بیماری در تبار آفریقایی
استفاده از توالییابی طولانیخوان در All of Us منجر به کشف واریانتهای ساختاری (SV) شده است که با روشهای قبلی قابل شناسایی نبودند. در یک زیرگروه از ۱۰,۰۰۰ شرکتکننده با تبار آفریقایی، محققان ۲۹۱ انجمن SV-بیماری را شناسایی کردند که نیمی از آنها در دادههای توالییابی کوتاه نادیده گرفته شده بودند. بسیاری از این SVها در نزدیکی لوکوسهای HLA (آنتیژن لکوسیت انسانی) قرار دارند که نقش محوری در بیماریهای خودایمنی و پاسخ به عفونتهایی مانند HIV ایفا میکنند.
| نوع بیماری خودایمنی/مرتبط | شیوع در زنان نسبت به مردان | واریانتهای کلیدی شناسایی شده (All of Us) |
|---|---|---|
| لوپوس سیستمیک (SLE) | ۹ به ۱ | واریانتهای TLR7 و HLA-DQB1 |
| اماس (MS) | ۳ به ۱ | واریانتهای مرتبط با فعالیت EBV |
| آرتریت روماتوئید (RA) | ۳ به ۱ | واریانتهای ساختاری در لوکوسهای ایمنی |
| آنتیبادی ضدهستهای (ANA+) | شایعتر در زنان | rs17211748 در نزدیکی HLA-DQB1 |
تحلیلهای ژنتیکی در All of Us همچنین نشان دادند که وجود آنتیبادیهای ضدهستهای (ANA) در افراد بدون علامت، وراثتپذیری حدود ۲۴.۹ درصدی دارد. شناسایی واریانت rs17211748 در بالادست HLA-DQB1 به عنوان قویترین نشانگر مرتبط با تولید ANA، مسیرهای جدیدی را برای پیشبینی مراحل اولیه خودایمنی پیش از بروز علائم بالینی باز کرده است.
موزائیسم سوماتیک و از دست رفتن کروموزوم Y (mLOY)
یکی از جنبههای تحولآفرین گزارش ۲۰۲۴، تمرکز بر تغییرات ژنتیکی است که نه در بدو تولد، بلکه در طول عمر فرد رخ میدهند. پدیده “از دست رفتن موزائیکی کروموزوم Y” (mLOY) در گلبولهای سفید خون مردان، شایعترین جهش سوماتیک در انسانهای در حال پیر شدن است.
پیامدهای فراتر از خونشناسی
برای دههها، mLOY به عنوان یک نشانگر بیضرر از پیری در نظر گرفته میشد. با این حال، دادههای گسترده All of Us و بیوبانک بریتانیا نشان میدهند که mLOY با طیف وسیعی از بیماریهای غیرخونی مرتبط است. در مردان مبتلا به mLOY، خطر ابتلا به موارد زیر به طور معناداری افزایش مییابد:
- بیماری آلزایمر (AD)، به دلیل تأثیر بر پاسخهای ایمنی مغز.
- بیماریهای قلبی-عروقی و نارسایی کلیه.
- سرطانهای غیرخونی و افزایش مرگومیر کلی.
مکانیسم پیشنهادی این است که سلولهای خونی که کروموزوم Y خود را از دست دادهاند، دچار تغییر در بیان ژنهای مرتبط با التهاب و عملکرد لنفوسیتهای T تنظیمی (Tregs) میشوند. این امر منجر به ایجاد یک محیط پیشالتهابی سیستمیک میشود که تخریب بافتها در قلب و مغز را تسریع میکند.
موزائیسم کروموزوم X در زنان
اگرچه کمتر مورد بحث قرار گرفته، اما از دست رفتن موزائیکی کروموزوم X (mLOX) نیز در زنان مسن مشاهده شده است. دادههای All of Us نشان میدهند که این پدیده ممکن است با خطر نارسایی زودرس تخمدان و برخی اختلالات متابولیک مرتبط باشد. شناسایی این موزائیسمها از طریق الگوریتمهای پیشرفتهای مانند GATK-SV در مطالعه ۲۰۲۴، دقت تشخیص را برای افرادی که copy ratio کروموزومی آنها بین حالتهای استاندارد (۱ یا ۲) قرار دارد، به شدت افزایش داده است.
چالشهای دادهای و نرخ ناسازگاری (Incongruence Rate)
یک یافته جالب و در عین حال هشداردهنده در گزارشهای سال ۲۰۲۴ All of Us، بررسی دقت سوابق الکترونیک سلامت (EHR) در مقایسه با دادههای ژنومیک است. محققان معیاری به نام “نرخ ناسازگاری” (IR) را برای سنجش تفاوت بین جنسیت ثبت شده در پرونده پزشکی و نشانگرهای ژنتیکی/بیولوژیک ابداع کردند.
دقت پروندههای پزشکی و مفاهیم بیولوژیک
در تحلیلی بر روی ۱۶۷ وضعیت پزشکی خاص جنسیت (مانند بارداری یا سرطان پروستات)، مشخص شد که نرخ ناسازگاری کلی حدود ۰.۸۶ درصد است. این بدان معناست که از هر ۱۰۰ نفر، نزدیک به یک نفر دارای تشخیص پزشکی در پرونده خود است که با جنسیت بیولوژیک او همخوانی ندارد. به عنوان مثال، ۴۴ نفر از میان ۴,۲۰۰ بیمار با تشخیص “کمکاری بیضه”، از نظر ژنتیکی زن (XX) بودند.
| وضعیت پزشکی خاص جنسیت | تعداد کل بیماران در All of Us | موارد ناسازگار (جنسیت مخالف) | نرخ ناسازگاری (IR) |
|---|---|---|---|
| کمکاری بیضه (Testicular Hypofunction) | ۴,۲۰۰ | ۴۴ | ۱.۰۵٪ |
| افتادگی ارگانهای تناسلی زنانه | ۲,۱۰۰ | ۲۱ | ۱.۰۰٪ |
| مجموع کل وضعیتهای خاص جنسیت | ۱۳۳,۰۳۶ | ~۱,۱۰۰ | ۰.۸۶٪ |
این ناسازگاریها لزوماً نشاندهنده پدیدههای بیولوژیک پیچیده نیستند، بلکه اغلب ناشی از خطاهای سیستماتیک در ورود دادهها در سیستم بهداشت و درمان ایالات متحده میباشند. با این حال، استفاده از دادههای ژنومیک به عنوان “استاندارد طلایی” برای پاکسازی این دادهها، اهمیت ادغام ژنتیک در مدیریت کلان سلامت را دوچندان میکند. همچنین، این دادهها نشان دادند که برای افراد غیردوتایی (Non-binary) و ترنسجندر، مدلهای دادهای فعلی در EHR به شدت ناقص بوده و نیاز به بازنگری دارند تا مراقبتهای تایید جنسیت و نیازهای بیولوژیک خاص آنها به درستی ثبت شود.
معماری ژنتیکی تفاوتهای جنسی در مغز و رفتار
گزارش All of Us در سال ۲۰۲۴ همچنین به بررسی تفاوتهای جنسی در ساختار مغز و اختلالات روانی پرداخته است. برخلاف باورهای عمومی مبنی بر دیمورفیسم شدید مغز، دادههای حاصل از کوهورتهای بزرگ نشان میدهند که همپوشانی بین مغز زنان و مردان بسیار بیشتر از تفاوتهای آنهاست.
تفاوت در واریانس و نه میانگین
تحقیقات نشان داد که اگرچه به طور متوسط حجم مغز مردان حدود ۹ تا ۱۰ درصد بزرگتر است، اما این تفاوت با تعدیل اندازه بدن به شدت کاهش مییابد. نکته کلیدی در دادههای ۲۰۲۴ این است که مردان “واریانس” یا پراکندگی بیشتری در ویژگیهای مغزی نشان میدهند. به عبارت دیگر، مغزهای بسیار بزرگ یا بسیار کوچک در مردان شایعتر است، در حالی که زنان در توزیع میانگین متمرکزتر هستند.
در حوزه سلامت روان، تفاوتهای جنسی در وراثتپذیری اختلالات اضطرابی با استفاده از دادههای All of Us و UK Biobank (شامل بیش از ۳۶۹,۰۰۰ نفر) مورد بررسی قرار گرفت. نتایج نشان داد:
- تعداد لوکوسهای ژنتیکی شناسایی شده در زنان (۲۶ مورد) به مراتب بیشتر از مردان (۶ مورد) بود.
- وراثتپذیری اضطراب در مقیاس مسئولیت (Liability scale) در زنان به طور قابل توجهی بالاتر برآورد شد.
- همبستگی ژنتیکی بین دو جنس، اگرچه بالا بود، اما به طور معناداری با ۱.۰ تفاوت داشت که نشاندهنده معماری ژنتیکی “تا حدودی متمایز” است.
این یافتهها تأکید میکنند که برای درک واقعی بیماریهای روانی، باید تحلیلهای تفکیکشده بر اساس جنسیت انجام شود، زیرا ترکیب کردن دادههای زنان و مردان میتواند سیگنالهای ژنتیکی را که تنها در یک جنس قوی هستند، خنثی یا پنهان کند.
تکنولوژیهای نوین و کشف واریانتهای ساختاری
بخش قابل توجهی از میلیونها واریانت جدید در All of Us مربوط به واریانتهای ساختاری (SV) است که بیش از ۵۰ جفتباز طول دارند. این واریانتها به دلیل ماهیت تکراری و پیچیده آلوموزومها، پیش از این به سختی شناسایی میشدند.
قدرت توالییابی طولانیخوان (LRS)
توالییابی کوتاه (Short-read) در شناسایی واریانتهای واقع در مناطق غنی از تکرار مانند لوکوس CYP2D6 (مرتبط با متابولیسم داروها) یا مناطق تکرار شونده کروموزوم X دچار مشکل است. مطالعه ۲۰۲۴ با استفاده از LRS در بیش از ۱,۰۰۰ نمونه اولیه، چارچوبی را برای پیشبینی و ایمپیوتسازی (Imputation) بیش از ۷۵۰,۰۰۰ SV در کل کوهورت فراهم کرد.
این روش اجازه داد تا واریانتهای ساختاری جدیدی در ژنهایی مانند FMR1 (مرتبط با سندرم X شکننده) و HTT (مرتبط با بیماری هانتینگتون) شناسایی شوند که پیش از این از دیدرس خارج بودند. در تبار آفریقایی، شناسایی این SVهای “نامرئی” منجر به کشف پیوندهای جدیدی با بیماریهای مزمن شد که میتواند تفاوت در نتایج سلامت بین نژادها را توضیح دهد.
| نوع واریانت ژنتیکی | اندازه (bp) | فراوانی در All of Us (تخمین) | ابزار شناسایی کلیدی |
|---|---|---|---|
| SNV (تکنوکلئوتیدی) | ۱ | > ۱ میلیارد | srWGS (Illumina) |
| Indel (درج/حذف کوتاه) | ۱ تا ۵۰ | دهها میلیون | GATK |
| SV (ساختاری) | > ۵۰ | > ۱.۵ میلیون | LRS (PacBio/Oxford Nanopore) |
| mCNV (کپی چندگانه) | متغیر | هزاران مورد در لوکوسهای خاص | GATK-SV |
پیامدهای بالینی و اخلاقی پزشکی دقیق
ظهور این حجم عظیم از دادههای مربوط به واریانتهای کروموزوم جنسی، چالشهای اخلاقی و بالینی جدیدی را ایجاد کرده است. برنامه All of Us متعهد به بازگرداندن نتایج ژنتیکی به شرکتکنندگان است، به طوری که تا آوریل ۲۰۲۳ بیش از ۵۱,۰۰۰ نفر نتایج مربوط به ریسک بیماریهای ارثی خود را دریافت کردهاند.
غربالگری پیش از تولد و تشخیص زودهنگام
با افزایش دقت در شناسایی آنوپلوئیدیهای جنسی و واریانتهای مسبب “تغییر جنسیت ژنتیکی”، امکان تشخیص این شرایط حتی پیش از تولد از طریق تستهای غیرتهاجمی (NIPT) فراهم شده است. این امر پرسشهای عمیقی را در مورد نحوه مشاوره ژنتیک و مدیریت نوزادان با ابهام جنسیتی یا شرایط بینجنسی (Intersex) ایجاد میکند. دادههای All of Us نشان میدهند که بسیاری از این شرایط در طول زندگی تشخیص داده نمیشوند و تنها زمانی کشف میشوند که فرد با مشکلات باروری یا بیماریهای خودایمنی مواجه میگردد.
شخصیسازی درمان بر اساس جنسیت
کشف واریانتهای خاص جنسیت در متابولیسم داروها (فارماکوژنومیک) و پاسخهای ایمنی، ضرورت “پزشکی حساس به جنسیت” را تقویت میکند. برای مثال، تفاوت در کارایی استاتینها در زنان نسبت به مردان و ارتباط آن با واریانتهای خاص در لوکوسهای تنظیمکننده لیپید، نشان میدهد که دوزبندی داروها نباید بر اساس یک مدل واحد برای هر دو جنس باشد.
نتیجهگیری و چشمانداز آینده
مطالعه All of Us در سال ۲۰۲۴ با کشف میلیونها واریانت جدید در کروموزومهای جنسی، پارادایمهای سنتی زیستشناسی انسانی را بازتعریف کرده است. شواهد ارائه شده نشان میدهند که تعیین جنسیت بیولوژیک یک فرایند پویا و تحت تأثیر دوز ژنی، فرار از غیرفعالسازی کروموزوم X و جهشهای سوماتیک در طول زمان است.
نکات کلیدی و دستاوردهای راهبردی:
- فراتر از دوتایی: جنسیت بیولوژیک یک طیف ژنتیکی است که توسط تعاملات پیچیده بین آلوموزومها و اتوزومها هدایت میشود و شرایطی مانند SCA و AIS بخش طبیعی از این تنوع انسانی هستند.
- ریشههای خودایمنی: دوز ژنی کروموزوم X و مکانیسمهای فرار از غیرفعالسازی، توضیحی بنیادین برای شیوع بالاتر بیماریهای خودایمنی در زنان فراهم میکنند که میتواند به درمانهای هدفمندتر منجر شود.
- تأثیر پیری بر ژنوم جنسی: موزائیسمهای سوماتیک مانند mLOY، پیوندی حیاتی بین از دست رفتن اطلاعات ژنتیکی در کروموزومهای جنسی و بیماریهای مرتبط با سن مانند آلزایمر و نارساییهای قلبی ایجاد کردهاند.
- اهمیت تنوع نژادی: شناسایی واریانتهای ساختاری جدید در جمعیتهای غیراروپایی ثابت کرد که بدون در نظر گرفتن تنوع جهانی، بخش بزرگی از مکانیسمهای بیماریزا از دیدرس پزشکی پنهان میماند.
در نهایت، ادغام این دانش در سیستمهای سلامت نیازمند بهبود دقت سوابق الکترونیک و آموزش پزشکان برای درک تفاوتهای ظریف ژنتیکی بین جنسیتهاست. با پیشرفت به سمت هدف یک میلیون شرکتکننده، All of Us نه تنها نقشه دقیقتری از ژنوم انسانی ارائه میدهد، بلکه راه را برای عدالتی نوین در مراقبتهای بهداشتی هموار میکند؛ جایی که درمانها نه بر اساس کلیشهها، بلکه بر اساس واقعیتهای مولکولی هر فرد طراحی میشوند.
بازبینی توسط متخصص
بازبین علمی این مقاله
آیا سوالی درباره ژنتیک و جنسیت دارید؟
درک پیچیدگیهای ژنتیکی تعیین جنسیت و بیماریهای مرتبط با کروموزومهای جنسی میتواند به تشخیص دقیقتر و مدیریت بهتر سلامت کمک کند. اگر سوالی در این زمینه دارید، تیم ما آماده ارائه مشاوره تخصصی است.
دریافت مشاوره ژنتیک