پاتوژنز مقایسهای بدخیمیهای اولیه کبد
کارسینوم هپاتوسلولار در مقابل کلانژیوسارسینوم داخل کبدی در بستر اتیولوژیهای ویروسی، خودایمنی و متابولیک
1. مقدمه و چشمانداز اپیدمیولوژیک
سرطان اولیه کبد (Primary Liver Cancer – PLC) به عنوان یکی از چالشبرانگیزترین معضلات انکولوژی مدرن، ششمین سرطان شایع و سومین علت اصلی مرگومیر ناشی از سرطان در سراسر جهان محسوب میشود. این بار جهانی بیماری، نه تنها به دلیل پیشآگهی ضعیف و گزینههای درمانی محدود در مراحل پیشرفته، بلکه به واسطه تغییرات دینامیک و پیچیده در الگوهای اتیولوژیک آن است. چشمانداز PLC عمدتاً تحت سلطه دو موجودیت بافتشناسی متمایز است: کارسینوم هپاتوسلولار (Hepatocellular Carcinoma – HCC) و کلانژیوسارسینوم داخل کبدی (Intrahepatic Cholangiocarcinoma – iCCA).
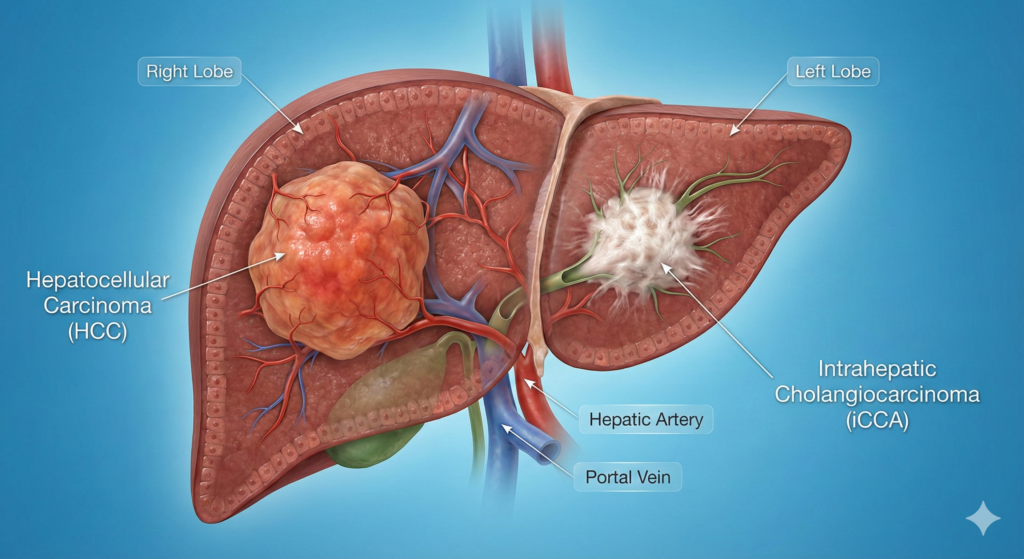
کارسینوم هپاتوسلولار (HCC) که از هپاتوسیتها یا سلولهای پارانشیمال کبدی منشاء میگیرد، شایعترین نوع سرطان کبد بوده و حدود 80 تا 90 درصد موارد را شامل میشود. در مقابل، کلانژیوسارسینوم داخل کبدی (iCCA) که از اپیتلیوم مجاری صفراوی (کلانژیوسیتها) نشأت میگیرد، دومین بدخیمی شایع کبدی است و تقریباً 10 تا 15 درصد موارد را به خود اختصاص میدهد. اگرچه هر دو تومور در بستر آناتومیک یکسانی (پارانشیم کبد) رشد میکنند، اما از نظر بیولوژی سلولی، پاتوژنز مولکولی، پاسخ به درمان و رفتار بالینی، تفاوتهای بنیادینی با یکدیگر دارند.
از لحاظ تاریخی، درک ما از کارسینوژنز کبد بر محوریت آسیب مزمن و التهاب مداوم استوار بوده است. برای دههها، عفونتهای مزمن ویروسی، به ویژه ویروس هپاتیت B (HBV) و ویروس هپاتیت C (HCV)، به همراه مصرف الکل، به عنوان محرکهای اصلی HCC شناخته میشدند. در سوی دیگر طیف، iCCA به طور سنتی با بیماریهای التهابی مزمن مجاری صفراوی، به ویژه کلانژیت اسکلروزان اولیه (Primary Sclerosing Cholangitis – PSC) و در مناطق خاصی از جهان با عفونتهای انگلی کبد (کبد فلوک)، پیوند خورده است.
با این حال، ما در حال گذر از یک نقطه عطف اپیدمیولوژیک هستیم. با ظهور همهگیری چاقی و سندرم متابولیک در سطح جهانی، اتیولوژیهای سنتی در حال واگذاری جایگاه خود به محرکهای متابولیک هستند. بیماری کبد چرب استئاتوتیک مرتبط با اختلال عملکرد متابولیک (Metabolic Dysfunction-Associated Steatotic Liver Disease – MASLD)، که پیشتر با نام کبد چرب غیرالکلی (NAFLD) شناخته میشد، اکنون به عنوان سریعترین علت رو به رشد برای هر دو نوع سرطان HCC و iCCA ظهور کرده است. این تغییر پارادایم، پیچیدگیهای مکانیسمی جدیدی را معرفی میکند که در آن لیپوتوکسیسیتی (سمیت چربی)، مقاومت به انسولین و اختلال در محور روده-کبد، نقشهای محوری را در تبدیل بدخیم سلولهای کبدی و صفراوی ایفا میکنند.
این گزارش جامع، با هدف ارائه یک تحلیل مقایسهای عمیق و دقیق، به بررسی مکانیسمهای پاتوفیزیولوژیک متمایز HCC و iCCA میپردازد. تمرکز ویژهای بر نقش سیروز و هپاتیت ویروسی در ایجاد HCC، در مقابل نقش التهاب صفراوی و PSC در توسعه iCCA خواهد بود. علاوه بر این، تأثیر فزاینده و پیچیده MASLD به عنوان یک نیروی کارسینوژنیک مشترک اما با مکانیسمهای متفاوت، مورد واکاوی قرار خواهد گرفت تا بینشهای نوینی را برای درک بهتر این بدخیمیهای کشنده فراهم آورد.
2. تمایز هیستوپاتولوژیک و منشاء سلولی: واگرایی بنیادین
برای درک صحیح تفاوتهای بالینی و مولکولی بین HCC و iCCA، ابتدا باید به ریشههای سلولی و تفاوتهای بافتشناسی آنها پرداخت. کبد انسان دارای دو رده سلولی اپیتلیال اصلی است: هپاتوسیتها که مسئول عملکردهای متابولیک و سنتتیک هستند، و کلانژیوسیتها که مجاری صفراوی را مفروش کرده و وظیفه تعدیل و انتقال صفرا را بر عهده دارند.
2.1 طیف منشاء سلولی و پلاستیسیته (Cellular Plasticity)
شواهد اخیر نشان میدهد که کارسینوژنز کبد تنها یک فرآیند خطی از سلول بالغ به سلول سرطانی نیست، بلکه شامل پدیدههای پیچیدهای از پلاستیسیته سلولی و تمایززدایی (Dedifferentiation) است.
- کارسینوم هپاتوسلولار (HCC): این تومور عمدتاً از هپاتوسیتهای بالغ منشاء میگیرد. در طی فرآیند آسیب مزمن و بازسازی (Regeneration)، هپاتوسیتها دچار تغییرات ژنتیکی و اپیژنتیکی شده، به حالت تمایزنایافتهتری بازمیگردند و ویژگیهای بدخیم پیدا میکنند.
- کلانژیوسارسینوم داخل کبدی (iCCA): منشاء این تومور ناهمگونتر است. در حالی که به طور کلاسیک تصور میشد که iCCA تنها از کلانژیوسیتهای پوشاننده مجاری صفراوی نشأت میگیرد، تحقیقات نوین نشان دادهاند که این تومورها میتوانند از سلولهای پیشساز کبدی (Hepatic Progenitor Cells – HPCs) واقع در کانالهای هرینگ، و حتی از طریق تراسدیفرنشیشن (Transdifferentiation) هپاتوسیتها به فنوتیپ صفراوی ایجاد شوند. این انعطافپذیری سلولی، به ویژه در زمینه بیماریهای متابولیک و التهابی مزمن، نقش کلیدی در ناهمگونی iCCA دارد.
- تومورهای ترکیبی (cHCC-CCA): وجود تومورهایی که ویژگیهای هر دو رده سلولی را نشان میدهند، دلیلی محکم بر وجود منشاء مشترک در سلولهای بنیادی/پیشساز کبدی است.
2.2 ویژگیهای هیستوپاتولوژیک افتراقی
تشخیص دقیق بین این دو بدخیمی بر اساس مورفولوژی بافتی و پروفایل ایمونوهیستوشیمی (IHC) صورت میگیرد. جدول زیر تفاوتهای کلیدی را خلاصه میکند:
| ویژگی | کارسینوم هپاتوسلولار (HCC) | کلانژیوسارسینوم داخل کبدی (iCCA) |
|---|---|---|
| الگوی تمایز | تمایز هپاتوسلولار؛ سلولها شبیه هپاتوسیتها هستند. | تمایز اپیتلیال صفراوی؛ تشکیل ساختارهای غددی. |
| الگوی رشد | توپر (Solid)، ترابکولار، و شبهغددی. | آدنوکارسینوم با استرومای دسموپلاستیک فراوان؛ ساختارهای لولهای. |
| استروما (بافت همبند) | استرومای اندک؛ قوام نرم تومور. شبکه عروقی غنی. | استرومای دسموپلاستیک متراکم (فیبروز شدید)؛ قوام سخت (“Scirrhous”). |
| ایمونوهیستوشیمی (IHC) | HepPar-1 (+), Arginase-1 (+), Glypican-3 (+) | CK7 (+), CK19 (+), MUC1 (+). منفی برای HepPar-1. |
| خونرسانی | هایپروسکولار (تقویت شدید شریانی). | هایپوواسکولار (تقویت محیطی). |
یکی از ویژگیهای بارز iCCA که آن را از HCC متمایز میکند، واکنش شدید دسموپلاستیک است. سلولهای تومورال iCCA با ترشح فاکتورهایی مانند TGF-beta، فیبروبلاستهای اطراف تومور را فعال کرده و باعث تولید مقادیر زیادی کلاژن میشوند. این بافت فیبروتیک متراکم نه تنها به عنوان یک سد فیزیکی در برابر داروهای شیمیدرمانی عمل میکند، بلکه باعث ایجاد مناطق هیپوکسیک میشود. در مقابل، HCC معمولاً توموری نرم و پرخون است.
2.3 ناهمگونی در کلانژیوسارسینوم داخل کبدی: زیرگروههای مجاری کوچک و بزرگ
یک پیشرفت حیاتی در آسیبشناسی iCCA، طبقهبندی آن به دو زیرگروه اصلی است که ارتباط مستقیمی با اتیولوژی بیماری دارد:
- نوع مجرای کوچک (Small Duct Type iCCA): از مجاری صفراوی کوچک محیطی منشاء میگیرد. این نوع به شدت با هپاتیت ویروسی و سندرم متابولیک (MASLD) مرتبط است و ویژگیهایی شبیه به HCC دارد.
- نوع مجرای بزرگ (Large Duct Type iCCA): از مجاری بزرگتر نزدیک به هیلم کبد منشاء میگیرد. این نوع به طور کلاسیک با بیماریهای التهابی مزمن صفراوی مانند PSC و عفونتهای انگلی مرتبط است و رفتار تهاجمیتری دارد.
3. کارسینوم هپاتوسلولار (HCC): پارادایم سیروز و هپاتیت ویروسی
پاتوژنز HCC عمیقاً با مفهوم “اثر میدان” (Field Effect) ناشی از آسیب مزمن کبد گره خورده است. در اکثریت قریب به اتفاق موارد، HCC در بستر یک کبد سیروتیک ایجاد میشود.
3.1 نقش محوری سیروز و التهاب مزمن
سیروز به خودی خود یک وضعیت پیشبدخیم محسوب میشود. چرخه مداوم نکروز هپاتوسیتها، التهاب مزمن و بازسازی جبرانی، محیطی را فراهم میکند که در آن جهشهای ژنتیکی انباشته شده و تکثیر سلولی کنترلنشده ترویج مییابد.
سندرم اختلال عملکرد ایمنی مرتبط با سیروز (CAIDS): بیماران مبتلا به سیروز دچار یک وضعیت پارادوکسیکال از التهاب سیستمیک و همزمان نقص ایمنی عملکردی میشوند. این وضعیت شامل فلج شدن سلولهای ایمنی و ناتوانی در حذف سلولهای بدخیم است.
3.2 مکانیسمهای کارسینوژنز در هپاتیتهای ویروسی
عفونت مزمن با ویروسهای هپاتیت B و C، قویترین محرکهای جهانی برای HCC هستند.
3.2.1 ویروس هپاتیت B (HBV): انکوژنز مستقیم و غیرمستقیم
HBV یک ویروس DNAدار است که میتواند حتی در غیاب سیروز نیز باعث ایجاد HCC شود. مکانیسمهای آن عبارتند از:
- ادغام ژنومی (Insertional Mutagenesis): DNA ویروس HBV میتواند در ژنوم میزبان ادغام شود و باعث فعالسازی انکوژنها یا غیرفعالسازی ژنهای سرکوبگر تومور شود.
- پروتئین ویروسی HBx: پروتئین HBx با پروتئین p53 متصل شده و عملکرد آن را مختل میکند و مسیرهای سیگنالینگ تکثیری را فعال مینماید.
- التهاب مزمن: پاسخ ایمنی میزبان منجر به تخریب مداوم هپاتوسیتها میشود.
3.2.2 ویروس هپاتیت C (HCV): استرس اکسیداتیو و متابولیک
برخلاف HBV، ویروس HCV یک ویروس RNAدار است و قابلیت ادغام در ژنوم میزبان را ندارد. کارسینوژنز عمدتاً از طریق مکانیسمهای غیرمستقیم رخ میدهد:
- استرس اکسیداتیو شدید: پروتئینهای ویروسی باعث اختلال در میتوکندری و تولید مقادیر زیادی ROS میشوند که باعث آسیب مستقیم به DNA میگردد.
- بازبرنامهریزی متابولیک (استئاتوز ویروسی): HCV باعث تجمع چربی در کبد (استئاتوز) میشود که خود یک محرک التهابی است.
- فیبروز پیشرونده: التهاب ناشی از HCV محرک قویتری برای فیبروز است و اکثر موارد HCC ناشی از HCV در بستر سیروز پیشرفته رخ میدهند.
4. کلانژیوسارسینوم داخل کبدی (iCCA): التهاب صفراوی و کلانژیت اسکلروزان اولیه (PSC)
در حالی که پاتوژنز HCC بر محور آسیب هپاتوسیتها میچرخد، iCCA (به ویژه نوع مجرای بزرگ) ریشه در التهاب درخت صفراوی دارد. بهترین مدل برای درک این فرآیند، بیماری PSC است.
4.1 پاتوفیزیولوژی PSC و کارسینوژنز صفراوی
PSC یک بیماری مزمن کلستاتیک است که با التهاب و فیبروز پیشرونده مجاری صفراوی مشخص میشود. این بیماری قویترین عامل خطر شناخته شده برای iCCA در کشورهای غربی است.
4.1.1 فیبروز “پوست پیازی” و کلستاز
مشخصه هیستولوژیک PSC، فیبروز هممرکز در اطراف مجاری صفراوی است (نمای “پوست پیازی”). این فیبروز باعث تنگی مجاری و رکود جریان صفرا (کلستاز) میشود. اسیدهای صفراوی سمی تجمع یافته، باعث آسیب DNA و مقاومت در برابر آپوپتوز میشوند.
4.1.2 محور روده-صفرا و نقش التهاب روده (IBD)
حدود 80 درصد بیماران مبتلا به PSC، همزمان به IBD مبتلا هستند. فرضیه “Homing” بیان میکند که لنفوسیتهای فعال شده در روده، به سمت کبد و مجاری صفراوی مهاجرت میکنند و پاسخ التهابی مزمن را حفظ مینمایند.
4.2 توالی التهاب-دیسپلازی-کارسینوم (BilIN)
در PSC، سرطان معمولاً از یک توالی پیشبدخیم به نام نئوپلازی داخل اپیتلیال صفراوی (BilIN) عبور میکند. التهاب مزمن و ترشح سیتوکینهایی مانند IL-6، مسیرهای تکثیری را در کلانژیوسیتها فعال میکند و باعث ناپایداری ژنتیکی و جهش در ژنهایی مانند KRAS و TP53 میشود.
5. تأثیر فزاینده اختلال عملکرد متابولیک (MASLD): موج سوم کارسینوژنز
ظهور بیماری کبد چرب استئاتوتیک (MASLD) چشمانداز سرطان کبد را دگرگون کرده است. MASLD یک عامل خطر مشترک برای هر دو نوع سرطان HCC و iCCA است.
5.1 اختلال متابولیک سیستمیک: سوخت مشترک برای سرطان
MASLD تظاهر کبدی سندرم متابولیک است. مقاومت به انسولین و هایپرانسولینمی، مسیرهای تکثیر سلولی را فعال میکنند. اختلال عملکرد بافت چربی و ترشح آدیپوکاینهای پیشالتهابی (مانند لپتین)، محیطی مناسب برای رشد تومور فراهم میآورد.
5.2 MASLD و کارسینوم هپاتوسلولار (HCC): پدیده غیرسیروتیک
در MASLD، درصد قابل توجهی از موارد HCC (تا 30 درصد) در غیاب سیروز پیشرفته رخ میدهد. مکانیسمهای کلیدی شامل:
- لیپوتوکسیسیتی: تجمع متابولیتهای سمی چربی باعث آسیب مستقیم سلولی میشود.
- استرس اکسیداتیو و ER Stress: بار اضافی چربی باعث تولید ROS و اختلال در فولدینگ پروتئینها میشود.
- سرکوب اتوفاژی: ناتوانی در حذف میتوکندریهای آسیبدیده منجر به ناپایداری ژنومی میشود.
5.3 MASLD و کلانژیوسارسینوم داخل کبدی (iCCA): پیوند با نوع مجرای کوچک
ارتباط اختصاصی بین MASLD و نوع مجرای کوچک iCCA یکی از یافتههای نوین است. در شرایط آسیب مزمن کبدی، هپاتوسیتها میتوانند دچار تغییر ماهیت شده و به سلولهای شبهصفراوی تبدیل شوند (Transdifferentiation) که میتواند منشاء iCCA باشد. التهاب ناشی از استئوپونتین و مسیر IL-6/STAT3 در این فرآیند نقش دارند.
5.4 نقش میکروبیوم و اسیدهای صفراوی
MASLD با دیسبیوزیس روده همراه است. تغییرات میکروبیوم، پروفایل اسیدهای صفراوی را تغییر داده و عملکرد گیرنده FXR (که نقش محافظتی دارد) را مختل میکند. نفوذپذیری روده نیز باعث ورود LPS به کبد و تحریک التهاب میشود.
6. همگرایی و واگرایی مولکولی: سنتز مقایسهای
تفاوت در اتیولوژی منجر به ایجاد پروفایلهای مولکولی متمایزی میشود که پیامدهای درمانی دارند.
| ویژگی | HCC (ویروسی/متابولیک) | iCCA (نوع مجرای کوچک) | iCCA (نوع مجرای بزرگ) |
|---|---|---|---|
| اتیولوژی غالب | HBV, HCV, الکل, MASLD | MASLD, هپاتیت ویروسی | PSC, کبد فلوک |
| منشاء سلولی | هپاتوسیت | سلول پیشساز / هپاتوسیت | کلانژیوسیت |
| جهشهای کلیدی | TERT, TP53, CTNNB1 | IDH1/2, FGFR2 fusions | KRAS, TP53, SMAD4 |
| هدفهای درمانی | مهار VEGF, ایمونوتراپی | مهارکنندههای FGFR2 و IDH1 | محدود (شیمیدرمانی) |
| پیشآگهی | متغیر | بهتر از نوع مجرای بزرگ | بسیار ضعیف |
این مقایسه نشان میدهد که iCCA نوع مجرای کوچک (مرتبط با متابولیک) از نظر مولکولی شباهتهایی به HCC دارد و از iCCA نوع مجرای بزرگ (مرتبط با PSC) متمایز است. این تمایز برای انتخاب درمانهای هدفمند نوین حیاتی است.
7. نتیجهگیری
تمایز بین HCC و iCCA فراتر از تفاوتهای ظاهری است؛ این دو سرطان نمایانگر نقاط پایانی مسیرهای پاتولوژیک متفاوتی هستند. HCC اساساً بیماری آسیب و بازسازی هپاتوسیتهاست که توسط سیروز ویروسی هدایت میشود. iCCA، به ویژه نوع مجرای بزرگ، بیماری التهاب صفراوی است که PSC نمونه بارز آن است.
در این میان، MASLD به عنوان یک نیروی انکوژنیک قدرتمند ظهور کرده است که با هر دو موجودیت ارتباط دارد. با کاهش شیوع هپاتیتهای ویروسی و افزایش شیوع چاقی، “مسیر متابولیک” به زودی بر چشمانداز سرطان کبد تسلط خواهد یافت. درک دقیق تفاوتهای مولکولی و بافتی، کلید اصلی در طراحی استراتژیهای غربالگری هوشمند و درمانهای دقیق در آینده خواهد بود.
بازبینی توسط متخصص
بازبین علمی این مقاله
آیا سابقه بیماریهای کبدی در خانواده دارید؟
درک زمینههای ژنتیکی و متابولیک سرطانهای کبد میتواند به تشخیص زودهنگام و پیشگیری کمک کند. اگر سوالی در مورد ریسک فاکتورهای خانوادگی دارید، تیم ما آماده ارائه مشاوره تخصصی است.
دریافت مشاوره ژنتیک