کاردیومیوپاتی هیپرتروفیک (HCM): بیماری قلبی پنهان در جوانان
راهنمای جامع شناخت، خطرات ژنتیکی و مدیریت
بخش ۱. کاردیومیوپاتی هیپرتروفیک (HCM) چیست؟ رمزگشایی یک بیماری ژنتیکی
کاردیومیوپاتی هیپرتروفیک (Hypertrophic Cardiomyopathy – HCM) یک بیماری پیچیده و اغلب پنهان قلبی است که در صدر فهرست علل مرگ ناگهانی قلبی (SCD) در جوانان و ورزشکاران قرار دارد. این بیماری، که با شیوع تخمینی ۱ در ۵۰۰ نفر، شایعترین بیماری قلبی ژنتیکی محسوب میشود، اغلب تا زمان وقوع یک حادثه تراژیک، ناشناخته باقی میماند. درک ماهیت دقیق HCM، به ویژه تمایز آن از تغییرات طبیعی قلب در ورزشکاران، اولین گام حیاتی برای خانوادههای در معرض خطر و جامعه ورزشی است.
تعریف دقیق: فراتر از یک «قلب ضخیم»
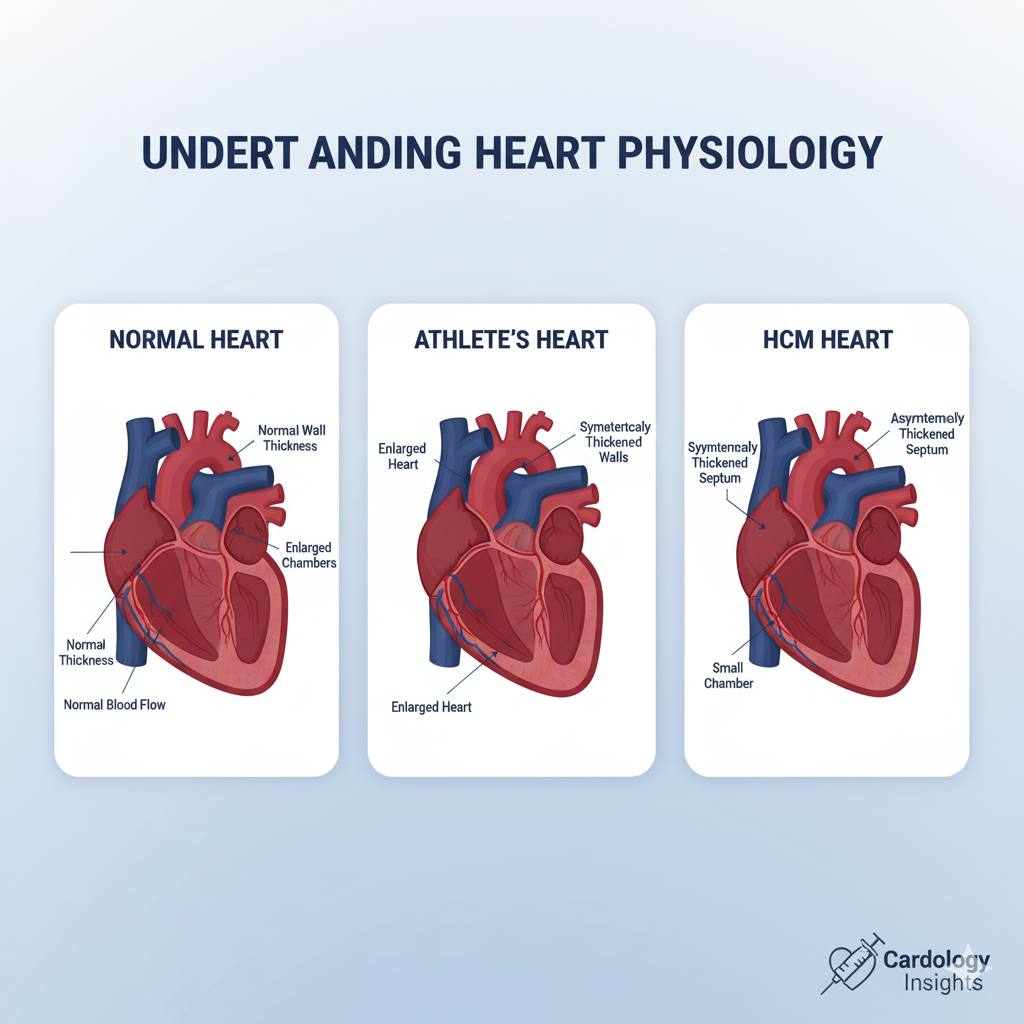
در سطح پایه، HCM به عنوان ضخیم شدن (هیپرتروفی) عضله قلب (میوکارد) تعریف میشود که در غیاب یک علت واضح دیگر رخ میدهد. به عبارت دیگر، این ضخامت ناشی از فشار خون بالا مزمن یا یک مشکل دریچهای مانند تنگی دریچه آئورت نیست. این ضخیم شدن معمولاً نامتقارن است و اغلب، دیواره بین دو بطن (سپتوم بطنی) را به طور نامتناسبی بیشتر از سایر دیوارهها درگیر میکند. در بزرگسالان، ضخامت دیواره بطن چپ (LVWT) به میزان ۱۵ میلیمتر یا بیشتر ( $\geq 15$ mm) به عنوان استاندارد تشخیصی در نظر گرفته میشود.
اما مشکل اصلی در HCM صرفاً ضخامت نیست، بلکه کیفیت و ساختار خود عضله است. HCM یک بیماری در سطح سلولی است. بر خلاف ضخیم شدن هماهنگ و منظمی که در پاسخ به ورزش رخ میدهد، هیپرتروفی در HCM به صورت «بیقاعده و بیش از حد و نامتناسب» است. عضله ضخیم شده در HCM «فاقد نظم و فعالیت نرمال» است. این توصیف به دو پدیده میکروسکوپی کلیدی اشاره دارد:
- ناهنجاری آرایش میوفیبریلی (Myofibrillar Disarray): سلولهای عضلانی قلب به جای آرایش موازی و کارآمد، به شکلی آشفته و درهمتنیده رشد میکنند.
- فیبروز (Fibrosis): در بین این سلولهای آشفته، بافت اسکار (کلاژن) تجمع مییابد.
بنابراین، تعریف دقیقتر HCM این است: یک بیماری ژنتیکی سارکومرها که باعث رشد آشفته، بینظم و فیبروتیک سلولهای عضلانی قلب میشود. این ساختار معیوب، پایه و اساس تمام خطرات بعدی بیماری، به ویژه آریتمیهای کشنده است.
چالش تشخیصی «منطقه خاکستری»: افتراق HCM از «قلب ورزشکار»
بزرگترین چالش تشخیصی برای مخاطبان این گزارش—ورزشکاران—در «منطقه خاکستری» (Gray Zone) نهفته است. ورزشکاران استقامتی نخبه، در پاسخ به تمرینات شدید، دچار ضخیم شدن فیزیولوژیک و سازگار عضله قلب میشوند که به آن «قلب ورزشکار» (Athlete’s Heart) میگویند.
“منطقه خاکستری” به ضخامت دیواره بطن چپ بین ۱۳ تا ۱۵ میلیمتر ( 13-15 mm) اطلاق میشود، جایی که هیپرتروفی فیزیولوژیک در ورزشکاران نخبه و هیپرتروفی پاتولوژیک در HCM خفیف با هم همپوشانی دارند. افتراق این دو حالت، که برای تصمیمگیری در مورد ادامه فعالیت ورزشی یا توقف آن (و در نتیجه نجات جان) حیاتی است، هرگز بر اساس یک عدد واحد (ضخامت) انجام نمیشود. بلکه، این افتراق نیازمند یک ارزیابی چند وجهی است که در جدول زیر خلاصه شده است.
| ویژگی | قلب ورزشکار (هیپرتروفی فیزیولوژیک) | کاردیومیوپاتی هیپرتروفیک (HCM) |
|---|---|---|
| ضخامت دیواره بطن چپ | معمولاً < 15 mm (اغلب 13-14 mm در منطقه خاکستری) | اغلب $\geq 15$ mm (اما میتواند در منطقه خاکستری باشد) |
| الگوی هیپرتروفی | متقارن، یکنواخت و هماهنگ | نامتقارن، به ویژه ضخیم شدن سپتوم |
| اندازه حفره بطن چپ | اغلب بزرگ شده (اتساع یافته) ( > 55 mm) | نرمال یا کوچک شده ( < 45 mm)؛ حفره فشرده شده |
| عملکرد دیاستولیک | نرمال یا حتی بهبود یافته (قلب به راحتی پر میشود) | تقریباً همیشه مختل (اختلال در ریلکسیشن؛ قلب سفت است) |
| MRI قلب (LGE) | بسیار نادر ( < 5 %)، فیبروز وجود ندارد | شایع ( 57-75 %)، نشاندهنده فیبروز (اسکار) است |
| سابقه خانوادگی HCM | منفی | اغلب مثبت |
| پاسخ به قطع ورزش | هیپرتروفی پس از چند هفته توقف تمرین، پسرفت میکند | هیپرتروفی با توقف تمرین تغییری نکرده و باقی میماند |
بخش ۲. چرا HCM خطرناک است؟ تهدید دوگانه: انسداد و آریتمی
درک اینکه چرا یک عضله ضخیم میتواند کشنده باشد، برای مدیریت ریسک ضروری است. خطر HCM ماهیتی دوگانه دارد: یک خطر «مکانیکی» که باعث ایجاد علائم ناتوانکننده میشود و یک خطر «الکتریکی» که عامل مرگ ناگهانی است.
خطر اول: انسداد مکانیکی جریان خون (HOCM)
در حدود ۷۰ درصد از بیماران مبتلا به HCM، سپتوم ضخیم شده به شدت به داخل مسیر خروجی بطن چپ (Left Ventricular Outflow Tract – LVOT) برآمده میشود. این مسیر، دریچهای است که خون از طریق آن قلب را ترک کرده و وارد شریان اصلی بدن (آئورت) میشود.
این برآمدگی عضلانی مانند یک سد عمل کرده و مسیر خروج خون از قلب را مسدود یا تنگ میکند. این حالت، «کاردیومیوپاتی هیپرتروفیک انسدادی» (HOCM) نامیده میشود. قلب برای پمپاژ خون از این مجرای تنگ، مجبور است با فشار بسیار بالاتری کار کند که این امر منجر به علائم کلاسیک HCM مانند تنگی نفس و درد قفسه سینه حین فعالیت میشود.
این انسداد اغلب با یک پدیده ثانویه به نام «حرکت سیستولیک قدامی» (Systolic Anterior Motion – SAM) دریچه میترال تشدید میشود. در HOCM، به دلیل تغییر هندسه قلب، لبه جلویی دریچه میترال به جای بسته شدن، به سمت سپتوم ضخیم شده کشیده میشود. این حرکت (SAM) نه تنها مسیر خروجی را بیشتر مسدود میکند، بلکه باعث نارسایی دریچه میترال و بازگشت خون به دهلیز چپ نیز میشود.
خطر اصلی: «اتصال کوتاه» الکتریکی و مرگ ناگهانی قلبی (SCD)
خطرناکترین جنبه HCM، انسداد مکانیکی نیست. انسداد باعث ایجاد علائم میشود؛ اما این ناهنجاری ساختاری است که باعث مرگ میشود. HCM به عنوان شایعترین علت مرگ ناگهانی قلبی (SCD) در افراد زیر ۳۵ سال، به ویژه ورزشکاران، شناخته میشود. تحقیقات نشان میدهد که HCM به تنهایی عامل حدود یک سوم از کل مرگهای ناگهانی مرتبط با ورزش است.
این مرگ ناگهانی، یک «حمله قلبی» (انسداد عروق کرونر) نیست؛ بلکه یک «ایست قلبی» (Cardiac Arrest) ناشی از یک «اتصال کوتاه» الکتریکی است. مکانیسم دقیق آن، وقوع ناگهانی یک آریتمی بطنی کشنده است: یا «تاکیکاردی بطنی» (VT) یا «فیبریلاسیون بطنی» (VF). در این حالت، بطنها به جای پمپاژ، با سرعتی مرگبار ( 300-400 ضربه در دقیقه) میلرزند، جریان خون به مغز متوقف میشود و فرد در عرض چند دقیقه جان خود را از دست میدهد.
اما چرا این آریتمی رخ میدهد؟ پاسخ مستقیماً به تعریف بیماری در بخش ۱ بازمیگردد. عضله HCM فقط ضخیم نیست؛ بلکه «بینظم» (Disarrayed) و «فیبروتیک» (Fibrotic) است. این ساختار آشفته سلولی و بافت اسکار پراکنده، یک «بستر آریتمیزا» (Arrhythmogenic Substrate) عالی ایجاد میکند. این بافت اسکار نمیتواند ایمپالسهای الکتریکی را به طور طبیعی هدایت کند و باعث ایجاد مدارهای اتصال کوتاه (Re-entry) میشود که منجر به VT/VF میگردد.
تمرکز ویژه: چرا ورزشکاران؟
فعالیت بدنی شدید، به ویژه ورزشهای رقابتی و انفجاری، به عنوان یک محرک (Trigger) قوی برای این آریتمیهای کشنده عمل میکند. افزایش ناگهانی سطح آدرنالین، کمآبی بدن و فشار شدید بر روی این عضله بیمار و ناپایدار الکتریکی، میتواند جرقهای باشد که اتصال کوتاه را فعال کرده و منجر به VT/VF میشود. به همین دلیل است که اولین تظاهر HCM در یک ورزشکار جوان که ظاهراً سالم به نظر میرسد، متأسفانه میتواند آخرین تظاهر آن—یعنی مرگ ناگهانی در زمین بازی—باشد.
نکته حیاتی این است که یک فرد میتواند HCM غیر انسدادی داشته باشد (یعنی هیچ انسدادی نداشته باشد و احساس خوبی داشته باشد)، اما همچنان به دلیل وجود بستر فیبروتیک، در معرض خطر بالای مرگ ناگهانی باشد. این ماهیت پنهان، دلیل اصلی اهمیت تشخیص زودهنگام از طریق غربالگری است.
بخش ۳. علائم و تشخیص: چگونه بیماری پنهان را آشکار کنیم؟
یکی از موذیانهترین جنبههای HCM، ماهیت «پنهان» یا «خاموش» آن است. بسیاری از افراد مبتلا به HCM، هیچ علامتی را تجربه نمیکنند (Asymptomatic) یا علائم بسیار خفیف و غیراختصاصی دارند که به راحتی به خستگی یا عدم آمادگی بدنی نسبت داده میشود.
اگرچه ژنهای مسبب بیماری از بدو تولد وجود دارند، اما ضخیم شدن فیزیکی قلب (فنوتیپ) معمولاً تا سنین نوجوانی و بلوغ (دوران جهش رشد) ظاهر نمیشود. این ماهیت خاموش، دلیل اصلی این است که نمیتوان برای تشخیص، منتظر علائم ماند.
علائم هشداردهنده کلیدی (Red Flags)
در افرادی که علامتدار میشوند، علائم معمولاً در حین یا بلافاصله پس از فعالیت بدنی رخ میدهند. علائم هشداردهنده کلیدی عبارتند از:
- تنگی نفس (Dyspnea): شایعترین علامت، به ویژه تنگی نفس هنگام فعالیت.
- درد قفسه سینه (Angina): اغلب شبیه به درد آنژین قلبی است و به خصوص هنگام فعالیت رخ میدهد.
- تپش قلب (Palpitations): احساس ضربان قلب سریع، نامنظم یا کوبنده.
- غش کردن (Syncope) یا احساس پیش از غش (Presyncope): این یک علامت بسیار هشدار دهنده و جدی است. سنکوپ، به ویژه اگر در حین یا بلافاصله پس از ورزش رخ دهد، به عنوان یکی از قویترین عوامل خطر برای مرگ ناگهانی قلبی در نظر گرفته میشود.
جعبه ابزار تشخیصی: از سوء ظن تا قطعیت
تشخیص HCM نیازمند سطح بالایی از سوء ظن بالینی و استفاده هوشمندانه از ابزارهای تصویربرداری است.
۱. الکتروکاردیوگرام (ECG / نوار قلب)
ECG اغلب اولین سرنخ و یک ابزار غربالگری حیاتی است. اگرچه ECG به تنهایی نمیتواند HCM را تشخیص دهد، اما در حدود ۹۰٪ از بیماران مبتلا، یافتههای غیرطبیعی را نشان میدهد (مانند ولتاژهای الکتریکی بسیار بالا یا امواج T معکوس).
۲. اکوکاردیوگرام (Echocardiogram / اکوی قلب)
این ابزار تشخیصی کلیدی و خط اول برای تأیید HCM است. اکوکاردیوگرام یک سونوگرافی بدون درد از قلب است. این آزمایش میتواند:
- به طور دقیق ضخامت دیوارههای قلب را اندازهگیری کند.
- وجود و شدت انسداد مسیر خروجی (LVOTO) را ارزیابی کند.
- حرکت سیستولیک قدامی (SAM) دریچه میترال را مشاهده کند.
- عملکرد دیاستولیک (سفتی) بطن چپ را ارزیابی کند.
۳. MRI قلبی (Cardiac MRI / CMR)
اگر اکوکاردیوگرام ابزار تشخیص است، MRI قلبی ابزار طبقهبندی خطر (Risk Stratification) است. CMR یک فناوری تصویربرداری پیشرفته است که تصاویری با جزئیات خیرهکننده از ساختار و بافت قلب ارائه میدهد.
- دقت برتر: CMR در اندازهگیری دقیق ضخامت، به ویژه در نواحیای که اکو به خوبی نمیبیند، برتری دارد.
- تجسم فیبروز (LGE): مهمترین نقش CMR، توانایی آن در دیدن بافت اسکار (فیبروز) است. پس از تزریق ماده حاجب (گادولینیوم)، نواحی فیبروتیک، آن را در خود نگه میدارند و روشن دیده میشوند (Late Gadolinium Enhancement – LGE).
- اهمیت LGE: وجود و وسعت LGE (فیبروز) مستقیماً با «بستر آریتمیزا» مرتبط است و یک پیشبینیکننده قوی برای خطر آریتمیهای بطنی و مرگ ناگهانی قلبی است.
بخش ۴. علل و عوامل خطر: پیام محوری؛ HCM یک بیماری خانوادگی است
این بخش به هسته اصلی و پیام محوری این گزارش میپردازد. HCM یک بیماری ناشی از سبک زندگی، رژیم غذایی یا ورزش نیست؛ این یک اختلال ژنتیکی است که در خانوادهها جریان دارد.
شایعترین بیماری قلبی ارثی
کاردیومیوپاتی هیپرتروفیک (HCM) به طور قطعی، شایعترین بیماری قلبی ارثی (ژنتیکی) است. شیوع آن به طور شگفتانگیزی بالا است و تخمین زده میشود که ۱ نفر از هر ۵۰۰ نفر در جمعیت عمومی حامل این بیماری است. این آمار به این معناست که میلیونها نفر در سراسر جهان به این بیماری مبتلا هستند، در حالی که بسیاری از آنها از این تشخیص بیاطلاع باقی ماندهاند.
ژنهای سارکومری: ریشه مشکل
علت اصلی HCM، جهشهای (Mutations) ژنتیکی در ژنهایی است که پروتئینهای «سارکومر» (Sarcomere) را کد میکنند. سارکومرها، موتورهای انقباضی میکروسکوپی در هر سلول عضلانی قلب هستند. جهش در این ژنها منجر به تولید پروتئینهای معیوب میشود که باعث میشوند سلولهای عضلانی به شکلی ناکارآمد و آشفته رشد کنند.
بیش از ۱۱ ژن سارکومری مختلف شناسایی شدهاند، اما اکثریت موارد ناشی از جهش در تنها دو ژن هستند:
- MYBPC3 (کد کننده پروتئین C متصل شونده به میوزین)
- MYH7 (کد کننده زنجیره سنگین بتا میوزین)
الگوی وراثت «اتوزومال غالب» به چه معناست؟
HCM تقریباً همیشه با یک الگوی وراثتی به نام «اتوزومال غالب» (Autosomal Dominant) به ارث میرسد. درک این مفهوم برای خانوادهها بسیار مهم است. «اتوزومال غالب» به سه نکته ساده قابل ترجمه است:
- فقط یک نسخه از ژن جهش یافته (چه از پدر یا از مادر) برای ایجاد بیماری کافی است.
- این بیماری به جنسیت بستگی ندارد و پسران و دختران را به یک اندازه تحت تأثیر قرار میدهد.
- اگر یکی از والدین مبتلا به HCM باشد، هر یک از فرزندان او، ۵۰ درصد شانس به ارث بردن این ژن و در نتیجه ۵۰ درصد خطر ابتلا به بیماری را دارند.
نکته مهم دیگر، پدیده «نفوذ متغیر» (Variable Penetrance) است. این بدان معناست که حتی در یک خانواده واحد که همگی یک جهش ژنتیکی یکسان دارند، شدت بیماری میتواند به طور چشمگیری متفاوت باشد.
غربالگری: یک مسئولیت خانوادگی نجاتبخش
با توجه به الگوی وراثت ۵۰/۵۰، نتیجهگیری منطقی این است: در صورت تشخیص HCM در یک فرد، تمام بستگان درجه اول او (والدین، خواهران و برادران، و فرزندان) باید تحت غربالگری قرار گیرند. این فرآیند «غربالگری آبشاری» (Cascade Screening) نامیده میشود.
- مسیر ۱: غربالگری بالینی (مبتنی بر اکو و ECG): این روش سنتیتر است و شامل ارزیابی بستگان با نوار قلب و اکوکاردیوگرام است که معمولاً از حدود ۱۲ سالگی شروع شده و به صورت دورهای تکرار میشود.
- مسیر ۲: غربالگری ژنتیکی (رویکرد مدرن و قطعی): این روش کارآمدتر است.
- گام ۱: فرد مبتلا (پروباند) تحت آزمایش ژنتیک قرار میگیرد تا جهش دقیق مسبب بیماری در آن خانواده شناسایی شود.
- گام ۲: بستگان درجه اول فقط برای همان جهش خاص آزمایش میشوند.
- گام ۳ (نتیجه A – مثبت): اگر یکی از بستگان حامل آن جهش باشد، او “در معرض خطر” است و باید وارد پروتکل غربالگری بالینی مادامالعمر شود.
- گام ۴ (نتیجه B – منفی): اگر آن فرد، حامل جهش خانوادگی نباشد، او آزاد است. او بیماری را ندارد و نمیتواند آن را به فرزندانش منتقل کند و از تمام غربالگریهای آینده معاف میشود.
این قدرت واقعی آزمایش ژنتیک است. این فرآیند نه تنها برای شناسایی افراد در معرض خطر، بلکه برای آزاد کردن قطعی ۵۰٪ خوششانس خانواده از یک عمر عدم اطمینان طراحی شده است. مشاوره ژنتیک تخصصی بخش اساسی این فرآیند است.
بخش ۵. مدیریت و درمان: کنترل علائم و پیشگیری از مرگ ناگهانی
در حالی که HCM در حال حاضر درمان قطعی (Cure) ندارد، اما یک بیماری کاملاً قابل مدیریت (Manageable) است. اهداف مدیریت مدرن دوگانه است: ۱) کنترل علائم ناتوانکننده و ۲) پیشگیری از مرگ ناگهانی قلبی.
رویکرد ۱: کنترل علائم (درمان دارویی)
هدف داروهای خط اول، کاهش بار کاری قلب و دادن زمان بیشتر به بطن سفت شده برای پر شدن از خون است.
- داروهای خط اول (بتا-بلوکرها): داروهایی مانند بیزوپرولول یا متوپرولول سنگ بنای درمان علامتی HCM هستند. آنها ضربان قلب و فشار خون را کاهش میدهند و تنگی نفس و درد قفسه سینه را بهبود میبخشند.
- درمان هدفمند مولکولی (Mavacamten): این یک پیشرفت انقلابی در درمان HCM است. Mavacamten (با نام تجاری Camzyos) اولین دارویی است که به طور خاص برای پاتوفیزیولوژی HCM طراحی شده است. این دارو مستقیماً به سراغ موتور سارکومر رفته و فعالیت بیش از حد انقباضی عضله را کاهش میدهد. این امر انسداد مسیر خروجی را کاهش داده و منجر به بهبود چشمگیر در علائم و کیفیت زندگی بیماران میشود.
رویکرد ۲: درمان انسداد شدید (HOCM) (مداخلات تهاجمی)
برای بیمارانی که با وجود دریافت دارو، همچنان علائم ناتوانکنندهای دارند، گزینههای تهاجمیتری برای برداشتن فیزیکی انسداد وجود دارد.
- جراحی میوکتومی سپتال (Septal Myectomy): این روش «استاندارد طلایی» است. این یک جراحی قلب باز است که در آن جراح بخشی از عضله ضخیم شده سپتوم را که مسیر را مسدود کرده، میتراشد و برمیدارد.
- ابلیشن سپتال با الکل (Alcohol Septal Ablation): این یک روش کمتهاجمی مبتنی بر کاتتر است. متخصص قلب مقدار کمی الکل خالص را به شریان کوچکی که آن بخش ضخیم را خونرسانی میکند، تزریق میکند. الکل باعث ایجاد یک «حمله قلبی کنترل شده» کوچک در آن ناحیه شده و آن بافت در طی چند ماه کوچک میشود.
رویکرد ۳: پیشگیری از مرگ ناگهانی (SCD) (درمان الکتریکی)
این مهمترین بخش مدیریت برای بقای طولانیمدت در بیماران پرخطر است. این درمان ربطی به علائم ندارد.
دفیبریلاتور قابل کاشت (ICD / باتری شوکدهنده):
ICD یک «سپر نجات» و تنها درمان اثبات شده برای پیشگیری قطعی از مرگ ناگهانی در HCM است. ICD دستگاهی کوچک است که زیر پوست قفسه سینه کاشته میشود و به طور مداوم ریتم قلب را کنترل میکند. اگر دستگاه یک آریتمی کشنده (VT/VF) را تشخیص دهد، بلافاصله یک شوک الکتریکی قدرتمند به قلب وارد میکند، ریتم را به حالت عادی بازمیگرداند و از مرگ ناگهانی جلوگیری میکند.
چه کسی به ICD نیاز دارد؟
پیشگیری ثانویه (الزامی): هر فردی که قبلاً دچار ایست قلبی شده و زنده مانده است.
پیشگیری اولیه (تصمیمگیری حیاتی): برای افرادی که هرگز ایست قلبی نداشتهاند اما در معرض خطر بالا هستند. پزشکان از مدلهای پیشبینی خطر استفاده میکنند که عوامل زیر را ارزیابی میکنند:
- سابقه خانوادگی مرگ ناگهانی قلبی
- سنکوپ (غش کردن) بدون دلیل
- ضخامت دیواره بسیار شدید (معمولاً > 30 میلیمتر)
- آریتمیهای بطنی (مانند NSVT در هولتر مانیتورینگ)
- وجود فیبروز گسترده (LGE) در MRI قلبی
رویکرد ۴: تغییرات سبک زندگی (بازنگری در ورزش)
در گذشته، به بیماران HCM توصیه میشد که از هرگونه فعالیت ورزشی اجتناب کنند. این دیدگاه در حال تغییر است.
- ممنوعیتها: محدودیت برای ورزشهای رقابتی، شدید، با شدت بالا (HIIT) و انفجاری (مانند فوتبال، بسکتبال، وزنهبرداری سنگین) همچنان قویاً پابرجاست.
- توصیهها: در حال حاضر، فعالیت بدنی ایمن و متوسط (مانند پیادهروی سریع، شنای تفریحی) برای اکثر بیماران توصیه میشود.
تصمیم نهایی در مورد نوع و شدت ورزش باید یک تصمیم مشترک بین بیمار و متخصص قلب مسلط به HCM باشد.
در نتیجه، کاردیومیوپاتی هیپرتروفیک، اگرچه یک بیماری ژنتیکی شایع و بالقوه کشنده است، اما دیگر یک بیماری پنهان و غیرقابل کنترل نیست. با آگاهی، تشخیص زودهنگام از طریق تصویربرداری پیشرفته (اکو و CMR) و اجرای پیام محوری این گزارش—یعنی غربالگری خانوادگی و ژنتیکی—میتوان این تهدید را شناسایی کرد. با مدیریت مدرن، از درمانهای مولکولی جدید (Mavacamten) گرفته تا مداخلات جراحی و سپر محافظ ICD، میتوان علائم را کنترل کرد و به طور مؤثری از مرگ ناگهانی پیشگیری نمود و به اکثر بیماران اجازه داد تا زندگی طولانی و با کیفیتی داشته باشند.
بازبینی توسط متخصص
بازبین علمی این مقاله
آیا سابقه مرگ ناگهانی یا HCM در خانواده شما وجود دارد؟
HCM شایعترین بیماری قلبی ارثی و عامل اصلی مرگ ناگهانی در جوانان است. از آنجایی که این بیماری با شانس ۵۰٪ به ارث میرسد، غربالگری خانواده و مشاوره ژنتیک برای شناسایی افراد در معرض خطر و پیشگیری از فاجعه، حیاتی است.
دریافت مشاوره ژنتیک