گزارش جامع پاتوفیزیولوژی سیستمیک، طیف ایمونولوژیک و دینامیکهای ژن-محیط در بیماری التهابی روده (IBD)
تحلیلی عمیق بر مکانیسمهای مولکولی، معماری ژنتیکی و تظاهرات سیستمیک
۱. مقدمه: بازتعریف IBD به عنوان یک اختلال سیستمیک چندوجهی
بیماری التهابی روده (Inflammatory Bowel Disease – IBD) به طور سنتی به عنوان یک آسیبشناسی محدود به دستگاه گوارش شناخته میشد، اما پیشرفتهای اخیر در ایمونولوژی و ژنتیک مولکولی، این دیدگاه را به چالش کشیده و IBD را به عنوان یک اختلال سیستمیک با واسطه ایمنی بازتعریف کردهاند. این بیماری ناشی از همگرایی پیچیده بین استعداد ژنتیکی میزبان، دیسبیوز (Dysbiosis) میکروبیوتای روده و محرکهای محیطی است که منجر به پاسخ ایمنی تنظیمنشده و مزمن میشود. اگرچه فنوتیپهای کلاسیک بیماری کرون (Crohn’s Disease – CD) و کولیت اولسروز (Ulcerative Colitis – UC) دو قطب اصلی این طیف را تشکیل میدهند، شواهد بالینی و مولکولی حاکی از وجود یک پیوستار (Spectrum) بیماری است که در آن مرزهای تشخیصی گاهی محو میشوند.
درک مدرن از IBD فراتر از التهاب مخاطی است؛ این بیماری با اختلال در تنظیم سد اپیتلیال، نقص در ایمنی ذاتی (مانند اتوفاژی و عملکرد سلولهای پانت) و قطبش نابجای سلولهای T کمکی (Th cells) مشخص میشود. علاوه بر این، شیوع بالای تظاهرات خارج رودهای (EIMs) در چشم، پوست، مفاصل و کبد، که در برخی موارد مستقل از فعالیت بیماری روده پیشرفت میکنند، بر ماهیت سیستمیک این سندرم تأکید دارد. این گزارش با رویکردی عمیق و تحلیلی، مکانیسمهای مولکولی، معماری ژنتیکی، نقش فرضیه بهداشت و تظاهرات سیستمیک IBD را بررسی میکند.
۱.۱ طیف IBD و چالش کولیت نامشخص (Indeterminate Colitis)
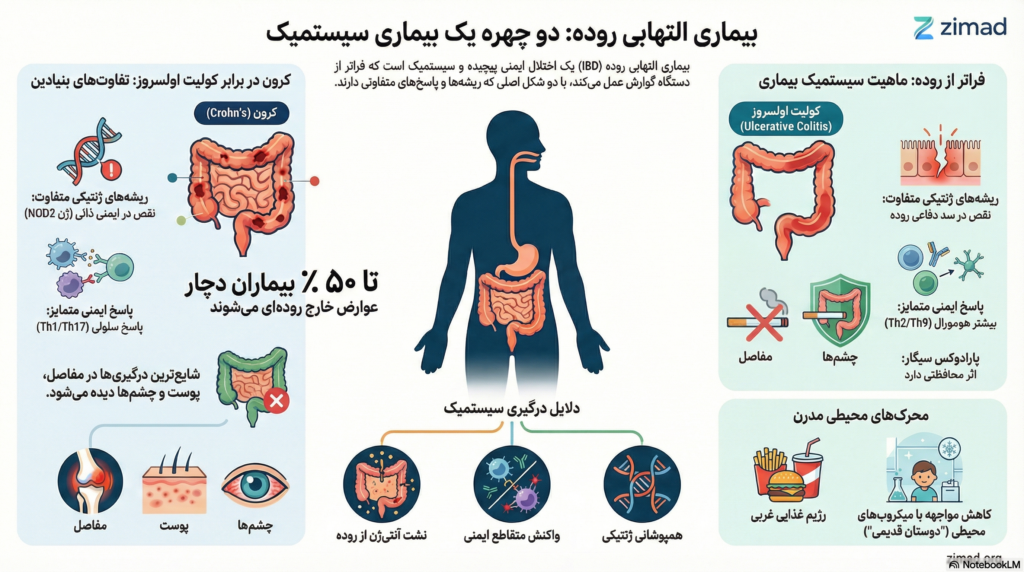
در حالی که طبقهبندی دوتایی (CD در برابر UC) برای مدیریت بالینی مفید است، واقعیت بیولوژیک پیچیدهتر است. بیماری کرون با التهاب تمامدیوارهای (Transmural)، ضایعات ناپیوسته (Skip lesions) و درگیری احتمالی هر بخش از لوله گوارش مشخص میشود، در حالی که کولیت اولسروز معمولاً محدود به مخاط (Mucosal) بوده و به صورت پیوسته از رکتوم به سمت پروگزیمال گسترش مییابد.
با این حال، در ۱۰ تا ۱۵ درصد از بیماران (و تا ۳۰٪ موارد در برخی مطالعات)، ویژگیهای بالینی، آندوسکوپیک و هیستولوژیک همپوشانی دارند، به طوری که تشخیص قطعی بین CD و UC در ابتدا امکانپذیر نیست. این وضعیت بالینی تحت عنوان “کولیت نامشخص” (Indeterminate Colitis – IC) یا “IBD طبقهبندینشده” (IBD-U) شناخته میشود. وجود IC نشاندهنده همپوشانی قابلتوجه در پاتوژنز بیماریهاست.
۲. معماری ژنتیکی: همپوشانیها و تمایزات مولکولی
مطالعات ارتباط ژنومی (GWAS) و متاآنالیزهای ترانس-اتنیک (Trans-ethnic) منجر به شناسایی بیش از ۲۰۰ جایگاه ژنتیکی (Risk Loci) مرتبط با IBD شدهاند. این یافتهها نشان میدهند که IBD یک بیماری پلیژنیک است. نکته کلیدی در درک ژنتیک IBD، تفکیک بین جایگاههای مشترک و اختصاصی است که مکانیسمهای پاتوفیزیولوژیک متفاوت را آشکار میسازد.
۲.۱ جایگاههای مشترک و مسیرهای ایمنی همگرا
اکثریت جایگاههای خطر شناسایی شده (حدود ۱۱۰ مورد از ۱۶۳ جایگاه اولیه) بین بیماری کرون و کولیت اولسروز مشترک هستند. مسیرهای بیولوژیکی مشترک شامل موارد زیر است:
- مسیر IL-23/Th17: ژنهای IL23R, IL12B, JAK2, STAT3 و CCR6 در هر دو بیماری نقش دارند. این مسیر در حفظ التهاب مزمن و فراخوانی نوتروفیلها حیاتی است.
- تنظیم سایتوکاینها: ژنهای IL10 و گیرندههای آن که در حفظ تحمل ایمنی (Tolerance) نسبت به میکروبیوتای روده نقش دارند، در هر دو فنوتیپ دخیل هستند.
۲.۲ امضای ژنتیکی اختصاصی بیماری کرون: نقش محوری نقص در ایمنی ذاتی
حدود ۳۰ جایگاه ژنتیکی به طور اختصاصی با بیماری کرون مرتبط هستند و تقریباً تمامی آنها به نقص در مکانیسمهای “ایمنی ذاتی” (Innate Immunity)، اتوفاژی و فاگوسیتوز اشاره دارند.
تحلیل عمیق ژن NOD2/CARD15
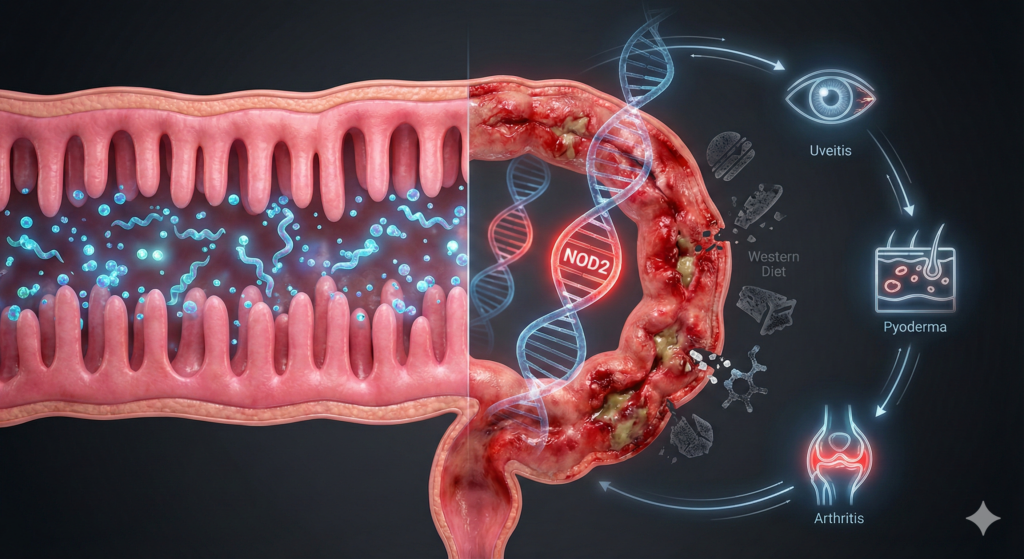
ژن NOD2 واقع در کروموزوم ۱۶، اولین و قویترین ژن مستعدکننده شناسایی شده برای بیماری کرون است. پروتئین NOD2 یک گیرنده سیتوزولی است که پپتیدوگلیکان باکتری را شناسایی میکند. جهشهای از دست دادن عملکرد در این ژن مکانیسمهای دفاعی روده را مختل میکنند:
- اختلال در عملکرد سلولهای پانت: نقص در NOD2 منجر به کاهش شدید دیفنسینها و تهاجم باکتریایی به کریپتهای روده میشود.
- نقص در اتوفاژی: NOD2 برای فراخوانی پروتئین اتوفاژی ATG16L1 ضروری است. فقدان آن منجر به بقای باکتری در داخل سلول و التهاب گرانولوماتوز مزمن میشود.
- عدم تنظیم مسیر TLR: فقدان مهار NOD2 باعث پاسخ بیش از حد التهابی (Th1-driven) به میکروبیوتای نرمال میشود.
| ویژگی | بیماری کرون (CD) | کولیت اولسروز (UC) | توضیحات و مکانیسم |
|---|---|---|---|
| جایگاههای ژنتیکی اختصاصی | NOD2, ATG16L1, IRGM | HLA-DQA1, HNF4A, CDH1 | CD مرتبط با نقص ایمنی ذاتی؛ UC مرتبط با نقص سد اپیتلیال |
| هریتایبیلیتی | بالاتر (تطابق ۵۰٪ در دوقلوها) | پایینتر (تطابق <۱۰٪) | نقش ژنتیک در CD پررنگتر از UC است |
| پاسخ غالب سلول T | Th1 و Th17 | Th2 آتیپیک و Th9 | CD با پاسخهای نوع ۱ و UC با پاسخهای نوع ۲ مرتبط است |
| الگوی میکروبیوم | کاهش Faecalibacterium prausnitzii | کاهش تنوع کلی | دیسبیوز در CD شدیدتر و موضعیتر است |
۲.۳ ژنتیک کولیت اولسروز: تمرکز بر سد اپیتلیال
در مقابل CD، بیست و سه جایگاه اختصاصی UC عمدتاً مربوط به عملکرد سد اپیتلیال (مانند HNF4A, LAMB1, CDH1) هستند. این یافتهها از فرضیه “نقص اولیه سد دفاعی” در UC حمایت میکنند، که در آن افزایش نفوذپذیری اپیتلیوم اجازه میدهد تا میکروبیوتای روده با سیستم ایمنی مخاطی تماس پیدا کرده و التهاب سطحی را تحریک کند.
۳. فرضیه بهداشت، “دوستان قدیمی” و محرکهای محیطی
افزایش چشمگیر شیوع IBD در نیمقرن اخیر، به ویژه در جوامع غربی، با تغییرات ژنتیکی قابل توجیه نیست و قویاً بر نقش عوامل محیطی دلالت دارد.
۳.۱ از “فرضیه بهداشت” تا تئوری “دوستان قدیمی” (Old Friends)
فرضیه بهداشت اولیه بیان میکرد که کاهش عفونتهای دوران کودکی منجر به عدم تعادل سیستم ایمنی میشود. در زمینه IBD، این فرضیه به تئوری “دوستان قدیمی” تکامل یافته است. بر اساس این تئوری، سیستم ایمنی انسان در طی میلیونها سال در همزیستی با ارگانیسمهای خاصی (مانند کرمهای انگلی و مایکوباکتریهای خاک) تکامل یافته است که مکانیسمهای تنظیم ایمنی را القا میکنند.
زندگی مدرن شهری با حذف این “دوستان قدیمی”، سیستم ایمنی را از ورودیهای تنظیمی محروم میکند. نتیجه این امر، ناتوانی در توسعه تحمل ایمنی و واکنش بیش از حد تهاجمی علیه آنتیژنهای بیخطر روده است.
۳.۲ رژیم غذایی غربی: سوخت التهاب
رژیم غذایی غربی به عنوان یکی از مهمترین محرکهای محیطی IBD شناخته میشود:
- افزودنیهای غذایی: موادی مانند امولسیفایرها لایه موکوس محافظ را نازک کرده و باکتریها را به تماس مستقیم با اپیتلیوم میکشانند.
- نمک: مصرف بالای نمک مسیر Th17 را فعال میکند که نقش مرکزی در خودایمنی دارد.
- چربیهای اشباع و قند: باعث کاهش باکتریهای تولیدکننده اسیدهای چرب کوتاه زنجیر (مانند بوتیرات) میشوند که برای سلامت روده حیاتی هستند.
۳.۳ پارادوکس سیگار: دوگانگی تأثیر در CD و UC
تأثیر سیگار بر IBD یکی از بارزترین نمونههای تعامل ژن-محیط است. در حالی که سیگار خطر ابتلا به بیماری کرون را ۲ برابر افزایش میدهد و سیر آن را وخیمتر میکند، در کولیت اولسروز اثر محافظتی دارد (کاهش خطر تا ۵۰٪). این پارادوکس نشان میدهد که عوامل محیطی یکسان میتوانند بسته به زمینه ژنتیکی و نوع پاسخ ایمنی، نتایج متفاوتی داشته باشند.
| اثر بالینی | بیماری کرون (CD) | کولیت اولسروز (UC) | مکانیسم پیشنهادی |
|---|---|---|---|
| ریسک ابتلا | افزایش خطر (۲ برابر) | اثر محافظتی (کاهش خطر) | UC: نیکوتین اثر ضدالتهابی دارد. |
| سیر بیماری | وخیمتر شدن | خفیفتر شدن در سیگاریها | CD: اختلال در جریان خون میکروسکوپی و تغییر به سمت Th1. |
| ترک سیگار | بهبود سیر بیماری | اغلب منجر به عود شدید میشود | تغییرات میکروبیوم ناشی از سیگار. |
۴. ایمنوپاتوژنز: آبشار التهابی
هنگامی که سد دفاعی شکسته میشود، پاسخ ایمنی در IBD شکل میگیرد.
۴.۱ قطبش سلولی و سایتوکاینها
بیماری کرون (Th1/Th17): با تولید بالای IL-12 و IL-23 مشخص میشود. IL-12 باعث تمایز سلولهای Th1 و IL-23 باعث بقای سلولهای Th17 میشود که منجر به تخریب بافتی و تشکیل گرانولوما میگردند.
کولیت اولسروز (Th2-like/Th9): با افزایش IL-5 و IL-13 همراه است که باعث آسیب اپیتلیال میشود. همچنین نقش سلولهای Th9 و سایتوکاین IL-9 در مهار ترمیم مخاطی برجسته شده است.
۴.۲ انعطافپذیری (Plasticity) سلولهای Th17
سلولهای Th17 در محیط التهابی میتوانند فنوتیپ خود را تغییر داده و به سلولهای Th17/Th1 تبدیل شوند که پتانسیل بیماریزایی بسیار بالایی دارند و به درمان مقاومترند. این پدیده اهمیت هدف قرار دادن مسیرهای بالادستی مانند IL-23 را نشان میدهد.
۵. ماهیت سیستمیک: تظاهرات خارج رودهای (EIMs)
بیماری IBD تنها التهاب روده نیست. تا ۵۰٪ از بیماران تظاهرات خارج رودهای را تجربه میکنند. پاتوفیزیولوژی EIMs از سه مکانیسم اصلی ناشی میشود: گسترش پاسخ ایمنی، واکنش متقاطع (Molecular Mimicry) و همپوشانی ژنتیکی.
۵.۱ تظاهرات اسکلتی-عضلانی
شایعترین EIM است. آرتریت محیطی معمولاً با فعالیت بیماری روده موازی است، در حالی که آرتریت محوری (مانند اسپوندیلیت آنکیلوزان) اغلب سیر مستقلی دارد و با ژن HLA-B27 مرتبط است.
۵.۲ تظاهرات پوستی
اریتم ندوزوم (EN): ندولهای قرمز دردناک روی ساق پا که معمولاً با کنترل بیماری روده بهبود مییابد.
پیودرما گانگرنوزوم (PG): زخمهای پوستی که ممکن است مستقل از فعالیت روده رخ دهند.
۵.۳ تظاهرات چشمی
یوئیت (التهاب لایه میانی چشم) یک اورژانس چشمپزشکی است که ارتباط قوی با ژن NOD2 دارد و اغلب سیر مستقلی از بیماری روده دارد.
۶. چشمانداز درمانی مبتنی بر پاتوفیزیولوژی
درمانهای مدرن مسیرهای دقیق پاتوژنیک را هدف قرار میدهند:
- مهار TNF-α (مانند اینفلیکسیمب): درمان التهاب روده و EIMs.
- مهار محور IL-12/23 (مانند استکینومب): مسدود کردن مسیرهای Th1 و Th17.
- مهار مهاجرت لکوسیت (مانند ودولیزومب): اثر اختصاصی بر روده با عوارض جانبی سیستمیک کم.
- مهارکنندگان JAK (مانند توفاسیتینیب): اثرات گسترده بر مهار التهاب سیستمیک.
۷. نتیجهگیری
بیماری التهابی روده یک سندرم پیچیده است که مرزهای سنتی بین ژنتیک، محیط و ایمونولوژی را در هم میشکند. IBD را باید به عنوان طیفی از اختلالات دید که در آن نقص در سد مخاطی و حسگرهای ایمنی در افراد مستعد ژنتیکی، اجازه میدهد تا عوامل محیطی یک پاسخ ایمنی مخرب را راهاندازی کنند. درک عمیق از تعاملات ظریف بین میکروبیوم، ژنتیک و محیط، راه را برای پزشکی دقیق هموار میکند.
بازبینی توسط متخصص
بازبین علمی این مقاله
آیا سابقه بیماریهای گوارشی در خانواده دارید؟
بیماریهای التهابی روده دارای زمینه ژنتیکی پیچیدهای هستند. اگر سابقه خانوادگی IBD دارید، مشاوره ژنتیک میتواند به درک بهتر ریسک و مدیریت پیشگیرانه کمک کند.
دریافت مشاوره ژنتیک