مرزهای ناشناخته زیستشناسی انسانی: از “تاریکخانه ژنوم” تا “انسانهای دوزیست”
بازتعریف حدود بیولوژیک انسان با نگاهی به اکتشافات ۲۰۲۴ و ۲۰۲۵
مقدمه: بازتعریف حدود بیولوژیک انسان
درک ما از چیستی “انسان” در دهههای اخیر دستخوش دگرگونیهای بنیادین شده است. برای سالها، مدلهای آناتومیک استاندارد و دگم مرکزی زیستشناسی مولکولی—که در آن DNA به RNA و سپس به پروتئین ترجمه میشود—مرزهای فیزیولوژی ما را تعریف میکردند. با این حال، اکتشافات خیرهکننده در سالهای ۲۰۲۴ و ۲۰۲۵، همراه با بازخوانی دقیقتر دادههای ژنومیک و مشاهدات میدانی در جمعیتهای ایزوله، نشان دادهاند که بدن انسان پلاستیسیته (انعطافپذیری) تکاملی بسیار فراتری از آنچه تصور میشد، دارد.
این گزارش جامع، با عبور از سطح ظاهری علم پزشکی، به اعماق ناشناختههای بیولوژیک انسان نفوذ میکند. ما سفر خود را از “انسانهای دوزیست”—جمعیتهایی که فیزیولوژی آنها برای زندگی در اعماق دریا تغییر یافته است—آغاز میکنیم. سپس به “تاریکخانه ژنوم” وارد میشویم، جایی که ۹۸ درصد از DNA ما که زمانی “زباله” نامیده میشد، اکنون به عنوان مرکز فرماندهی بیماریها و تکامل شناخته میشود. در ادامه، ناهنجاریهای نادر و سندرمهایی را بررسی میکنیم که قوانین حیات و مرگ را به چالش میکشند، و در نهایت به بررسی فناوریهایی میپردازیم که قصد دارند با مهندسی تکامل، آینده گونه انسان را بازنویسی کنند.
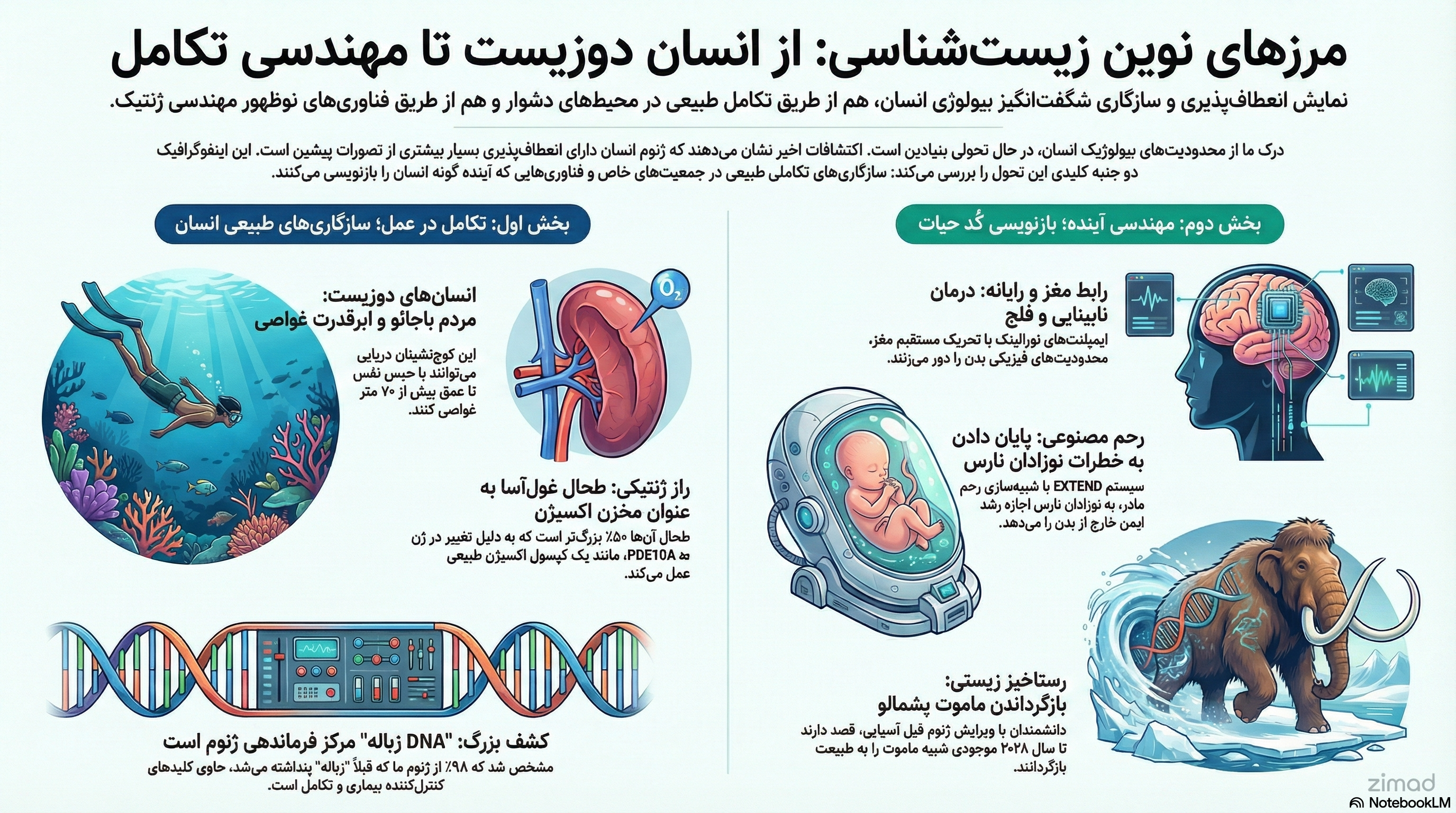
فصل اول: انسان دوزیست؛ انعطافپذیری تکاملی در اعماق
تکامل بیولوژیک اغلب به عنوان فرایندی کند و نامحسوس در مقیاس زمانی انسانی در نظر گرفته میشود. با این حال، شواهد موجود در جمعیتهای خاص نشان میدهد که فشارهای محیطی شدید میتواند منجر به تغییرات ژنتیکی و فیزیولوژیک سریع و قابل توجهی شود. بارزترین نمونه این پدیده در جمعیتهای “کوچنشینان دریایی” (Sea Nomads) در آسیای جنوب شرقی و غواصان سنتی شرق آسیا مشاهده میشود.
۱.۱. باجائو لائوت: مهندسی ژنتیک طبیعی برای هیپوکسی
مردم باجائو (Bajau) که در آبهای اندونزی، مالزی و فیلیپین زندگی میکنند، برای بیش از هزار سال سبک زندگی مبتنی بر غواصی آزاد (بدون تجهیزات) را حفظ کردهاند. آنها تا ۶۰ درصد از زمان کاری روزانه خود را زیر آب میگذرانند و میتوانند بدون هیچ ابزار کمکی به اعماق بیش از ۷۰ متر نفوذ کنند. این سبک زندگی منجر به انتخاب طبیعی صفاتی شده است که آنها را از همسایگان خشکیزی خود متمایز میکند.
۱.۱.۱. طحال به مثابه مخزن اکسیژن (The Biological Scuba Tank)
یکی از برجستهترین سازگاریهای باجائو، اندازه غیرطبیعی طحال آنهاست. در پستانداران دریایی مانند فوک ودل، طحال نقشی حیاتی در “رفلکس شیرجه” ایفا میکند. هنگام کمبود اکسیژن، طحال منقبض شده و مخزنی از گلبولهای قرمز اکسیژندار را به جریان خون پمپاژ میکند.
مطالعات اولتراسونوگرافی تطبیقی نشان دادهاند که میانگین اندازه طحال در افراد باجائو حدود ۵۰ درصد بزرگتر از همسایگان سالوآن آنهاست که سبک زندگی خشکیزی دارند. نکته کلیدی اینجاست که این بزرگی طحال حتی در افراد باجائو که هرگز غواصی نکردهاند نیز دیده میشود. این مشاهده اثبات میکند که صفت مذکور یک تغییر پلاستیک ناشی از تمرین نیست، بلکه یک سازگاری ژنتیکی است که در طول نسلها در ژنوم این جمعیت تثبیت شده است.
۱.۱.۲. مکانیسمهای ژنتیکی: ژنهای PDE10A و BDKRB2
تحلیلهای ژنومیک پیشرفته، دو جایگاه ژنی (Locus) کلیدی را مسئول این ابرقدرتهای فیزیولوژیک معرفی کردهاند:
- ژن PDE10A (فسفودیاستراز ۱۰A): محققان واریانت خاصی در ژن PDE10A را در باجائو شناسایی کردهاند. در باجائو، این واریانت با تغییر سطح هورمونهای تیروئیدی (تیروکسین) مرتبط است. هورمون تیروئید نقش شناختهشدهای در تکامل اندازه طحال در دوران جنینی دارد.
- ژن BDKRB2 (گیرنده برادیکینین B2): این ژن تنها ژنی است که به طور مستقیم با شدت “رفلکس شیرجه” در انسان مرتبط است. این گیرنده مسئول تنظیم انقباض عروق محیطی (Vasoconstriction) است. واریانتهای موجود در باجائو پدیده “شیفت خونی” (Blood Shift) را بهینهسازی کرده و بقای آنها را در شرایط هیپوکسی تضمین میکنند.
۱.۲. هِنیو و آما: همودینامیک در آبهای سرد
غواصان سنتی زن در جزیره ججو کره جنوبی (Haenyeo) و ژاپن (Ama) با چالش دیگری روبرو بودهاند: سرما.
- سازگاریهای متابولیک: این جمعیتها دارای نرخ متابولیسم پایه (BMR) بالاتر و آستانه لرزش بالاتری هستند که نشاندهنده تغییراتی در بافت چربی قهوهای است.
- یافتههای ۲۰۲۴/۲۰۲۵: مطالعات اخیر واریانتهای ژنتیکی جدیدی را در جمعیت هِنیو شناسایی کردهاند که با کاهش فشار خون در حین غواصی مرتبط است. این سازگاریها همودینامیک بدن را در شرایط استرسزای زیر آب پایدار نگه میدارند.
| جمعیت | عامل استرس محیطی | ژن کلیدی | پیامد فیزیولوژیک | مکانیسم عمل |
|---|---|---|---|---|
| باجائو | هیپوکسی دریایی | PDE10A | طحال بزرگ | افزایش حجم مخزن خونی طحال |
| باجائو | هیپوکسی دریایی | BDKRB2 | انقباض عروقی هوشمند | تقویت “شیفت خونی” به سمت مغز و قلب |
| هنیو (کره) | سرما و فشار آب | واریانتهای مرتبط | پایداری همودینامیک | جلوگیری از افزایش خطرناک فشار خون |
| تبتیها | هیپوکسی ارتفاع | EPAS1 | تنظیم هموگلوبین | جلوگیری از غلظت خون کشنده |
| اینوییها | سرمای قطبی | TBX15 / WARS2 | توزیع بافت چربی | تغییر پروفایل چربیسوزی برای تولید گرما |
فصل دوم: تاریکخانه ژنوم؛ معماری پنهان بیماریها
برای دههها، علم ژنتیک بر ۱ تا ۲ درصد از ژنوم که پروتئینها را کد میکند متمرکز بود. ۹۸ درصد باقیمانده اغلب با عنوان تحقیرآمیز “DNA زباله” نادیده گرفته میشد. اما انقلاب ژنومیک سالهای اخیر، این بخش عظیم را به عنوان “ماده تاریک ژنوم” (Dark Genome) بازشناسی کرده است.
۲.۱. کشف بزرگ RNU4-2 (۲۰۲۴/۲۰۲۵): کلید گمشده مغز
در یک کشف پیشگامانه که در سال ۲۰۲۴ در نشریه Nature منتشر شد، دانشمندان یک ژن غیر-کدکننده به نام RNU4-2 را شناسایی کردند که مسئول بخش قابل توجهی از ناهنجاریهای عصبی-تکاملی (NDDs) است.
مکانیسم: ژن RNU4-2 پروتئین نمیسازد، بلکه مولکول U4 snRNA را تولید میکند که یکی از اجزای اصلی “اسپلایسوزوم” (ماشین ویرایشگر سلول) است. جهش در این ژن باعث میشود اسپلایسوزوم نتواند هزاران ژن دیگر را به درستی پردازش کند. نتیجه بالینی، سندرمی شامل میکروسفالی، هیپوتونی و ناتوانی ذهنی شدید است. این جهش تکژنی به تنهایی مسئول حدود ۰.۴ درصد از کل ناهنجاریهای عصبی-تکاملی است.
۲.۲. رتروترانسپوزونها و “دشمن درون”
بخش تاریک ژنوم مملو از بقایای عفونتهای ویروسی باستانی است. این عناصر متحرک (ژنهای جهنده) میتوانند دوباره فعال شوند.
- LINE-1: این عنصر حدود ۱۷ درصد از کل ژنوم ما را تشکیل میدهد. در سرطان و پیری، خاموشی LINE-1 شکسته میشود و پرشهای آن میتوانند ژنهای سرکوبگر تومور را تخریب کنند.
- تقلید ویروسی (Viral Mimicry): وقتی عناصر باستانی فعال میشوند، RNAهای دو رشتهای تولید میکنند که سیستم ایمنی آنها را با ویروس خارجی اشتباه میگیرد. دانشمندان اکنون از این مکانیسم برای بیدار کردن سیستم ایمنی علیه تومورها استفاده میکنند.
۲.۳. بیماریهای افزاینده (Enhanceropathies)
افزایندهها توالیهای DNA هستند که ژنها را از راه دور روشن و خاموش میکنند. در سال ۲۰۲۴ مشخص شد که یک واریانت در یک افزاینده مرتبط با ژن SCN5A، عامل سندرم مرگبار قلبی بروگادا است.
فصل سوم: ناهنجاریهای فرم؛ آناتومی غیرممکن
بیماریهای نادر ژنتیکی نشان میدهند که مرز میان گوشت و استخوان چقدر شکننده است.
۳.۱. فیبرودیسپلازی استخوانیشونده پیشرونده (FOP): سندرم مرد سنگی
FOP شرایطی است که در آن بافتهای نرم بدن (عضله، تاندون) به تدریج به استخوان واقعی تبدیل میشوند. این بیماری ناشی از جهش در ژن ACVR1 است که باعث میشود گیرنده پروتئین مورفوژنیک استخوان (BMP) توسط اکتیوین A بیشفعال شود. هرگونه آسیب یا جراحی باعث تشدید استخوانسازی میشود. داروهای جدیدی مانند garetosmab در حال توسعه هستند.
۳.۲. جنین در جنین (Fetus in Fetu): دوقلوی انگلی
FIF یک دوقلوی همسان است که در مراحل اولیه جنینی توسط دوقلوی دیگر بلعیده شده است. برخلاف تراتوم، FIF دارای محور مهرهای است. گزارشهای اخیر مواردی از وجود FIF در داخل جمجمه را ثبت کردهاند.
۳.۳. سندرمهای مو و پوست
سندرم موی شانهنشونده: ناشی از جهش در ژنهای سازنده ساقه مو است که باعث میشود سطح مقطع مو به شکل مثلث یا قلب درآید و در برابر شانهزنی مقاومت کند.
فصل چهارم: ناهنجاریهای ذهن؛ وقتی واقعیت فرو میریزد
۴.۱. بیخوابی خانوادگی مرگبار (FFI)
یک بیماری پریونی ناشی از جهش در ژن PRNP است. پروتئینهای پریونی در تالموس تجمع مییابند و توانایی ورود به خواب عمیق را از بین میبرند. این وضعیت منجر به توهم، کما و در نهایت مرگ میشود.
۴.۲. توهم نفی وجود: سندرم کوتارد
بیماران باور دارند که مردهاند. این حالت ناشی از قطع ارتباط میان ناحیه تشخیص چهره و آمیگدال (مرکز احساسات) است. بیمار چهره خود را میبیند اما هیچ حس آشنایی دریافت نمیکند.
۴.۳. سایر سندرمها
- سندرم کاپگراس: اعتقاد به اینکه نزدیکان با یک “بدل” جایگزین شدهاند.
- سندرم آلیس در سرزمین عجایب (AIWS): تغییرات گذرا در درک اندازه بدن، ناشی از اختلال در محل اتصال گیجگاهی-آهیانه.
- سندرم خود-آبجوسازی: روده بیمار به دلیل رشد قارچها، کربوهیدرات را به الکل تبدیل میکند و فرد بدون مصرف الکل مست میشود.
فصل پنجم: مهندسی تکامل؛ عبور از مرزهای بیولوژی
۵.۱. رابطهای مغز و رایانه (BCI): نورالینک
تلهپاتی: ایمپلنت N1 به بیماران فلج اجازه میدهد با ذهن خود تایپ کنند.
بلایندسایت (Blindsight): دستگاهی که چشم را دور میزند و مستقیماً قشر بینایی را تحریک میکند تا پتانسیل دیدن را حتی در نابینایان مادرزاد ایجاد کند.
۵.۲. بیوکامپیوترها و هوش ارگانوئیدی
استفاده از ارگانوئیدهای مغزی انسان متصل به الکترود برای پردازش داده. این سیستمها مصرف انرژی بسیار کمتری نسبت به سختافزارهای فعلی دارند.
۵.۳. رحم مصنوعی: اکتوجنسیس
سیستم EXTEND برای نوزادان نارس طراحی شده است. جنین در مایع مصنوعی غوطهور میشود و تبادل گاز از طریق بند ناف مصنوعی انجام میشود.
۵.۴. رستاخیز زیستی
پروژه احیای ماموت پشمالو با استفاده از ویرایش ژنومی فیل آسیایی برای ایجاد صفات مقاوم به سرما، با هدف بازگرداندن اکوسیستم قطب شمال.
نتیجهگیری: همگرایی مرزها
مطالعه زیستشناسی انسانی از مرحله مشاهده به مرحله دستکاری وارد شده است. باجائو و هِنیو اثبات میکنند که تکامل متوقف نشده است. “ماده تاریک ژنوم” منبع پیچیدگی ماست. ناهنجاریهای نادر کلیدهای درک مکانیسمهای حیات هستند. و با فناوریهایی مانند نورالینک و رحم مصنوعی، ما وارد عصری میشویم که محدودیتهای بیولوژیک به عنوان مسائل مهندسی قابل حل نگریسته میشوند.
بازبینی توسط متخصص
بازبین علمی این مقاله
کنجکاو درباره اسرار ژنتیک خود هستید؟
علم ژنتیک مرزهای جدیدی را در درک سلامت و هویت انسان گشوده است. اگر در مورد بیماریهای نادر، غربالگری ژنتیکی یا فناوریهای نوین سوالی دارید، تیم ما آماده ارائه مشاوره تخصصی است.
دریافت مشاوره ژنتیک