گزارش جامع تحلیلی: پاتوفیزیولوژی، تظاهرات بالینی و انکولوژی کولیت اولسراتیو
تحلیلی عمیق بر مکانیسمها، تشخیص افتراقی و مدیریت سرطان وابسته به کولیت
۱. مقدمه: چارچوب مفهومی و بار بیماری
کولیت اولسراتیو (Ulcerative Colitis – UC) یک بیماری التهابی مزمن، ایدیوپاتیک و ناتوانکننده روده بزرگ است که به عنوان یکی از دو زیرمجموعه اصلی بیماریهای التهابی روده (IBD) شناخته میشود. این بیماری با یک پاسخ ایمنی تنظیمنشده و مخرب به میکروبیوتای همزیست روده در افراد مستعد ژنتیکی مشخص میشود. برخلاف بیماری کرون که میتواند هر بخشی از دستگاه گوارش را به صورت تمامجداری (Transmural) و ناپیوسته درگیر کند، کولیت اولسراتیو دارای دو ویژگی پاتولوژیک بنیادین است که هویت بالینی آن را تعریف میکنند: محدودیت به مخاط (Mucosal Confinement) و التهاب پیوسته (Continuous Inflammation) که از رکتوم آغاز شده و به سمت پروکسیمال گسترش مییابد.
در دهههای اخیر، اپیدمیولوژی UC دستخوش تغییرات قابل توجهی شده است. در حالی که این بیماری به طور سنتی بیماری کشورهای صنعتی و غربی تلقی میشد، افزایش چشمگیر شیوع آن در کشورهای در حال توسعه (مانند چین و کشورهای خاورمیانه) نشاندهنده نقش محوری عوامل محیطی و سبک زندگی در پاتوژنز آن است. بار بیماری نه تنها ناشی از علائم حاد گوارشی مانند اسهال خونی و تنسموس است، بلکه به دلیل پیامدهای بلندمدت آن، به ویژه خطر فزاینده سرطان کولورکتال (Colitis-Associated Cancer – CAC)، چالشهای عمدهای را برای سیستمهای بهداشتی ایجاد میکند. این گزارش با رویکردی عمیق و چندبعدی، به تحلیل مکانیسمهای مولکولی بیماری، تمایزات بالینی دقیق، و استراتژیهای مدرن نظارت بر سرطان میپردازد.
۲. پاتوبیولوژی و مکانیسمهای مولکولی: فراتر از التهاب سطحی
برای درک ماهیت بالینی کولیت اولسراتیو، لازم است مکانیسمهای سلولی و مولکولی که منجر به تخریب مخاطی میشوند، با دقت بررسی شوند. شواهد نشان میدهد که UC نتیجه یک تعامل پیچیده بین سد اپیتلیال معیوب، دیسبیوزیس میکروبی و پاسخ ایمنی ذاتی و اکتسابی است.
۲.۱. نقص در سد مخاطی و دیسبیوزیس
در سطح مولکولی، یکی از اولین رویدادها در UC، اختلال در لایه مخاطی محافظ و اتصالات محکم (Tight Junctions) بین سلولهای اپیتلیال است. کاهش تولید موسین توسط سلولهای جامی (Goblet Cells) و تغییر در ترکیب گلیکوپروتئینهای مخاطی، اجازه میدهد باکتریهای لومینال در تماس مستقیم با اپیتلیوم قرار گیرند.
مطالعات میکروبیوم انسانی نشان دادهاند که بیماران مبتلا به UC دچار کاهش شدید در تنوع میکروبی هستند. به طور خاص:
- کاهش باکتریهای محافظ: سطوح باکتریهای تولیدکننده اسیدهای چرب کوتاه زنجیر (SCFA) مانند Ruminococcaceae و Lachnospiraceae کاهش مییابد. اسیدهای چرب کوتاه زنجیر، به ویژه بوتیرات، منبع انرژی اصلی کولونوسیتها هستند و نقش ضدالتهابی دارند.
- افزایش باکتریهای پیشالتهابی: وفور میکروارگانیسمهای بیماریزا مانند Enterobacteriaceae افزایش مییابد که میتوانند پاسخهای ایمنی را تحریک کنند.
۲.۲. پاسخ ایمنی و مولکولهای چسبندگی
پس از نفوذ آنتیژنهای باکتریایی به لامینا پروپریا، پاسخ ایمنی شدیدی آغاز میشود. یکی از مکانیسمهای کلیدی در حفظ و تشدید التهاب در UC، تنظیم مثبت (Upregulation) مولکول چسبندگی سلولی مخاطی-۱ (MAdCAM-1) بر روی اندوتلیوم عروق خونی مخاط است. این مولکول مانند یک “آهنربا” عمل کرده و لکوسیتهای بیانکننده اینتگرین آلفا-۴-بتا-۷ (α4β7) را از گردش خون به بافت مخاطی فرا میخواند. این مکانیسم، اساس درمانهای بیولوژیک مدرن (مانند ودولیزوماب) است که به طور اختصاصی از مهاجرت گلبولهای سفید به روده جلوگیری میکنند. علاوه بر این، مسیر سیگنالینگ NF-κB در سلولهای اپیتلیال و ایمنی فعال شده و منجر به تولید انبوه سیتوکینهای التهابی مانند TNF-α، IL-6 و IL-1β میشود که چرخه معیوب تخریب بافتی را تداوم میبخشند.
۳. تحلیل هیستوپاتولوژیک: تعریف دقیق ماهیت بیماری
تشخیص قطعی و درک رفتار بالینی UC وابسته به شناسایی الگوهای بافتی خاصی است که آن را از سایر کولیتها متمایز میکند.
۳.۱. محدودیت مخاطی (Mucosal Confinement)
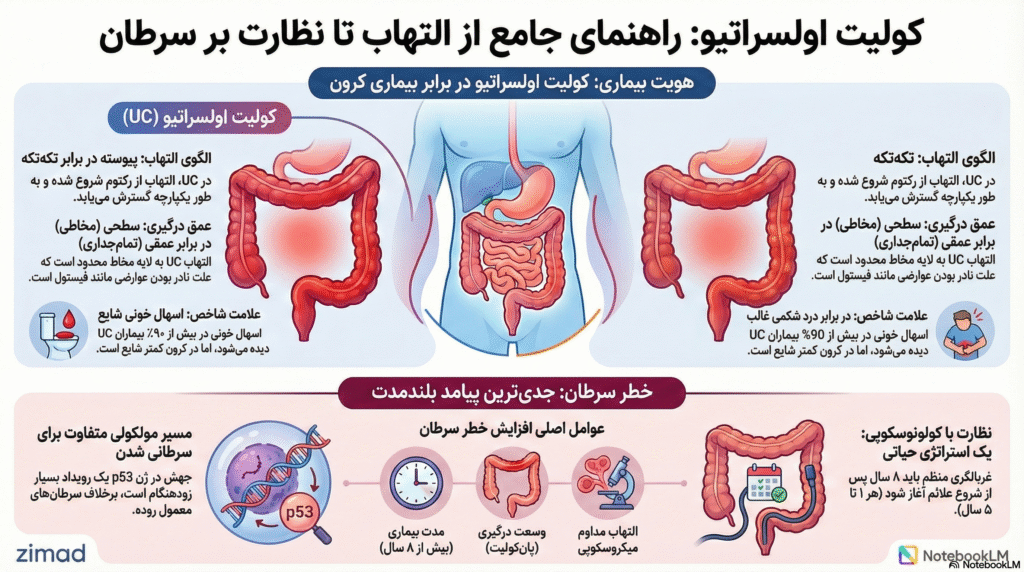
التهاب در UC به طور کلاسیک به مخاط (Mucosa) و لایه سطحی زیرمخاط (Submucosa) محدود میشود. لایه عضلانی (Muscularis Propria) و سروز معمولاً دستنخورده باقی میمانند، مگر در موارد بسیار شدید مانند مگاکولون سمی (Toxic Megacolon). این ویژگی آناتومیک توضیح میدهد چرا عوارض تمامجداری (Transmural) مانند فیستولسازی، آبسههای داخل شکمی و تنگیهای فیبروتیک (Strictures) که در بیماری کرون شایع هستند، در UC به ندرت دیده میشوند. در UC، التهاب به صورت افقی در سطح مخاط گسترش مییابد، در حالی که در کرون، التهاب به صورت عمودی به عمق دیواره نفوذ میکند.
۳.۲. پیوستگی التهاب (Continuous Inflammation)
برخلاف بیماری کرون که با ضایعات ناپیوسته و “پرشی” (Skip Lesions) مشخص میشود، UC دارای یک الگوی توزیع پیوسته و متقارن است. بیماری تقریباً در ۹۵٪ موارد رکتوم را درگیر میکند (Proctitis) و از آنجا بدون هیچ وقفه یا ناحیه سالمی به سمت پروکسیمال کولون پیشروی میکند. این پیوستگی به حدی مشخصه بیماری است که وجود نواحی سالم مخاطی در بین نواحی ملتهب (قبل از درمان)، باید تشخیص UC را زیر سوال ببرد.
۳.۳. نشانگرهای میکروسکوپی مزمنیت
در ارزیابی بیوپسی، پاتولوژیستها به دنبال شواهدی هستند که نشاندهنده مزمن بودن بیماری باشد تا آن را از کولیتهای حاد عفونی افتراق دهند. دو یافته کلیدی عبارتند از:
- پلاسماسیتوز بازال (Basal Plasmacytosis): حضور سلولهای پلاسما در قاعده کریپتها. این یافته یکی از اولین و پایدارترین نشانههای IBD است و پیشبینیکننده قوی برای عود بیماری (Relapse) محسوب میشود.
- تغییرات ساختاری کریپت (Crypt Distortion): کریپتهای کولون در حالت طبیعی مانند لولههای آزمایش مستقیم هستند. در UC، به دلیل دورههای مکرر تخریب و بازسازی، کریپتها کوتاه، دوشاخه، کج و نامنظم میشوند.
۴. تظاهرات بالینی: کالبدشکافی اسهال خونی و تنسموس
علائم بالینی کولیت اولسراتیو بازتاب مستقیم پاتوفیزیولوژی مخاطی و رکتال آن است. دو علامت “اسهال خونی” و “تنسموس” به عنوان ستونهای اصلی تابلوی بالینی این بیماری شناخته میشوند.
۴.۱. پدیده اسهال خونی (Bloody Diarrhea): مکانیسمهای مولکولی
اسهال خونی در بیش از ۹۰٪ بیماران مبتلا به UC دیده میشود. تحقیقات نشان دادهاند که اسهال در IBD صرفاً ناشی از تخریب بافتی نیست، بلکه ناشی از اختلالات مولکولی در انتقال یونها است:
- اختلال در بازجذب سدیم و کلر: التهاب باعث کاهش بیان ناقلهای اصلی جذب نمک (NHE3 و DRA) میشود. سیتوکینهای التهابی مستقیماً رونویسی ژنهای کدکننده این ناقلها را سرکوب میکنند. نتیجه، باقی ماندن نمک و آب در لومن روده و ایجاد اسهال اسموتیک/ترشحی است.
- مکانیسم نشت (Leak Flux Mechanism): آسیب به پروتئینهای اتصالات محکم باعث افزایش نفوذپذیری پاراسلولی میشود. این امر اجازه میدهد مایع غنی از پروتئین و خون از بافت ملتهب به داخل لومن نشت کند.
- کاهش فعالیت ENaC و پمپ سدیم-پتاسیم: التهاب همچنین فعالیت کانال سدیم اپیتلیال (ENaC) و پمپ Na+/K+-ATPase را کاهش میدهد که نیروی محرکه برای جذب آب را از بین میبرد.
۴.۲. تنسموس (Tenesmus): زجرآورترین علامت پروکتیت
تنسموس، که به عنوان احساس نیاز فوری، دردناک و مداوم برای دفع مدفوع با وجود تخلیه ناکامل تعریف میشود، نشانگر اختصاصی التهاب رکتوم (پروکتیت) است.
پاتوفیزیولوژی عصبی-عضلانی تنسموس:
- حساسیت احشایی (Visceral Hypersensitivity): التهاب مزمن باعث تغییر در آستانه تحریک گیرندگان حسی در دیواره رکتوم میشود. اعصاب آوران رکتوم در UC حتی با مقادیر اندک خون یا چرک تحریک شده و سیگنال کاذب “پری رکتوم” را ارسال میکنند.
- کاهش انطباقپذیری رکتوم (Rectal Compliance): فیبروز و ادم دیواره رکتوم باعث میشود این عضو خاصیت ارتجاعی خود را از دست داده و به یک لوله سفت تبدیل شود که نمیتواند به عنوان مخزن عمل کند.
- اسپاسم عضلانی: تحریک مداوم رکتوم منجر به انقباضات غیرارادی و دردناک اسفنکتر داخلی میشود. تمایز این علامت از یبوست بسیار حیاتی است.
۵. تحلیل تطبیقی: کولیت اولسراتیو در برابر سایر IBDها
تشخیص افتراقی بین UC و بیماری کرون (CD) همواره چالشبرانگیز است، اما الگوهای بالینی و پاتولوژیک خاصی وجود دارند که این دو را متمایز میکنند.
| ویژگی بالینی/پاتولوژیک | کولیت اولسراتیو (UC) | بیماری کرون (CD) | توضیحات و مکانیسم |
|---|---|---|---|
| توزیع آناتومیک | محدود به کولون | تمام لوله گوارش | در UC روده باریک درگیر نیست (مگر در ایلیت بکواش). |
| الگوی التهاب | پیوسته (Continuous) | تکهتکه (Skip Lesions) | نواحی سالم بین ضایعات، مشخصه کرون است. |
| عمق درگیری | مخاط و زیرمخاط | تمامجداری (Transmural) | علت فیستول در کرون، نفوذ عمقی است. |
| اسهال خونی | بسیار شایع (۹۵-۹۰٪) | کمتر شایع | در کرون، اسهال بیشتر ناشی از سوءجذب است. |
| تنسموس | شایع | نادر | مگر در موارد درگیری شدید رکتوم در کرون. |
| گرانولوما | نادر | شایع (تا ۳۰٪) | گرانولومای غیرکازئوز مشخصه کرون است. |
| عوارض پریآنال | نادر | شایع | بیماری پریآنال قویاً به نفع کرون است. |
| درد شکمی | کرامپی، اغلب LLQ | مداوم، اغلب RLQ | درد RLQ در کرون ناشی از ایلیت ترمینال است. |
۵.۲. چالشهای تشخیصی و استثناهای “پیوستگی”
اگرچه قانون کلی در UC “پیوستگی” است، چندین استثنا وجود دارد که میتواند منجر به خطای تشخیصی شود:
- وصله سکال (Cecal Patch): در کولیت سمت چپ، ممکن است التهابی محدود در اطراف دهانه آپاندیس دیده شود. این پدیده نباید با “ضایعات پرشی” کرون اشتباه گرفته شود.
- رکتال اسپرینگ درمانی (Therapeutic Rectal Sparing): در بیمارانی که تحت درمان موضعی (انما) قرار گرفتهاند، ممکن است التهاب رکتوم بهبود یابد در حالی که التهاب بالاتر فعال است. این “تکهتکه شدن” مصنوعی است.
- ایلیت بکواش (Backwash Ileitis): در پانکولیت اولسراتیو، التهاب میتواند چند سانتیمتر انتهایی ایلئوم را درگیر کند. مکانیسم آن احتمالاً ریفلاکس محتویات ملتهب کولون است. برخلاف کرون، این التهاب سطحی است و با درمان کولیت بهبود مییابد.
۶. تغییرات ساختاری و عوارض مزمن
التهاب طولانیمدت منجر به تغییرات مورفولوژیک برگشتناپذیر در ساختار کولون میشود.
۶.۱. کولون لوله سربی (Lead Pipe Colon)
این اصطلاح رادیولوژیک به ظاهر صاف، کوتاه و بدون چینخوردگی (Haustra) کولون اشاره دارد. مکانیسم آن ترکیبی از هیپرتروفی عضلانی و بازسازی سریع مخاط است که باعث میشود چینهای طبیعی روده محو شده و روده ظاهری لولهمانند و سفت پیدا کند.
۶.۲. سودوپولیپها (Pseudopolyps)
سودوپولیپها جزایر باقیمانده از مخاط سالم یا در حال بازسازی هستند که در میان دریایی از زخمهای فرورفته قرار گرفتهاند. اهمیت بالینی آنها در این است که میتوانند ضایعات دیسپلاستیک واقعی را پنهان کنند و نظارت اندوسکوپی را دشوار سازند. وجود سودوپولیپهای متعدد میتواند بیمار را در گروه خطر متوسط برای سرطان قرار دهد.
۷. پیامدهای بلندمدت: کارسینوژنز و خطر سرطان کولورکتال
جدیترین پیامد بلندمدت کولیت اولسراتیو، توسعه سرطان کولورکتال وابسته به کولیت (CAC) است.
۷.۱. مکانیسم مولکولی: تفاوت CAC با سرطان اسپورادیک
مسیر تبدیل شدن به سرطان در UC متفاوت از سرطانهای معمولی روده است:
- توالی زمانی جهشها: در سرطانهای وابسته به کولیت (CAC)، جهش در ژن p53 یک رویداد بسیار زودهنگام است که حتی در مخاطی که هنوز دیسپلازی ندارد، رخ میدهد. برعکس، جهش APC در مراحل دیررس است.
- نقش استرس اکسیداتیو: التهاب مزمن باعث تولید رادیکالهای آزاد میشود که مستقیماً به DNA سلولهای اپیتلیال حمله کرده و باعث بیثباتی ژنومی میشوند.
- مسیر NF-κB: فعالسازی این مسیر در سلولهای اپیتلیال، مانع از آپوپتوز سلولهای جهشیافته میشود و تولید سیتوکینهای محرک رشد تومور (مانند IL-6) را افزایش میدهد.
۷.۲. عوامل خطر بالینی برای سرطان
- وسعت بیماری: پانکولیت بیشترین خطر را دارد.
- مدت زمان: خطر پس از ۸ سال بیماری فعال بالا میرود.
- کلانژیت اسکلروزان اولیه (PSC): همراهی PSC با UC، خطر سرطان را به شدت افزایش میدهد (تا ۵ برابر).
- التهاب هیستولوژیک مداوم: وجود التهاب میکروسکوپی خطر دیسپلازی را بالا میبرد.
۸. استراتژیهای نظارت و مدیریت: ضرورت و پروتکلها
با توجه به ماهیت تهاجمی سرطانهای وابسته به کولیت، پروتکلهای نظارتی سختگیرانهای تدوین شده است.
۸.۱. دستورالعملهای نظارتی (ACG, ECCO, BSG)
نظارت باید ۸ سال پس از شروع علائم آغاز شود. فواصل نظارت:
- پرخطر (سالانه): بیماران مبتلا به PSC، سابقه دیسپلازی، تنگی کولون، یا سابقه فامیلی سرطان روده در سنین پایین.
- خطر متوسط (هر ۲ تا ۳ سال): بیماران با التهاب خفیف فعال یا سودوپولیپهای متعدد.
- خطر کم (هر ۵ سال): بیماران در بهبودی کامل.
۸.۲. تکامل تکنیکها: از بیوپسی تصادفی تا کرومواندوسکوپی
تحول بزرگ با معرفی کرومواندوسکوپی (Chromoendoscopy) رخ داد. در این روش، رنگهایی مانند متیلن بلو بر روی مخاط اسپری میشود تا ضایعات ظریف دیسپلاستیک را آشکار کند. این روش نرخ تشخیص دیسپلازی را به طور قابل توجهی افزایش میدهد.
۸.۳. مدیریت دیسپلازی: اجماع SCENIC
کشف دیسپلازی دیگر به معنای حکم قطعی برای جراحی نیست. اگر دیسپلازی قابل مشاهده باشد و بتوان آن را به طور کامل با روشهای اندوسکوپیک برداشت، جراحی لازم نیست. اما اگر دیسپلازی نامرئی باشد و در بیوپسیهای تصادفی یافت شود، کولکتومی توصیه میشود زیرا خطر سرطان همزمان بالاست.
۹. نتیجهگیری نهایی
کولیت اولسراتیو یک بیماری چندوجهی است که در آن اختلالات ژنتیکی و محیطی منجر به یک پاسخ التهابی پیوسته و محدود به مخاط میشوند. تظاهرات بالینی آن، از جمله اسهال خونی و تنسموس، مستقیماً از پاتوفیزیولوژی خاص آن ناشی میشوند. درک دقیق تمایزات آن با بیماری کرون و آگاهی از استثناهایی مانند “ایلیت بکواش” برای مدیریت صحیح بالینی ضروری است. مهمتر از همه، با توجه به مسیرهای مولکولی منحصربهفرد سرطانزایی، اجرای پروتکلهای نظارتی دقیق و استفاده از تکنیکهای نوین مانند کرومواندوسکوپی، سنگ بنای پیشگیری از مرگومیر ناشی از سرطان است. هدف نهایی درمان در حال گذار از “بهبودی بالینی” به “بهبودی هیستولوژیک” است.
بازبینی توسط متخصص
بازبین علمی این مقاله
آیا سابقه خانوادگی بیماریهای التهابی روده دارید؟
بیماریهای التهابی روده (IBD) دارای زمینه ژنتیکی قوی هستند. اگر سابقه خانوادگی کولیت اولسراتیو یا بیماری کرون دارید، مشاوره ژنتیک میتواند به درک بهتر ریسک و برنامهریزی برای غربالگری کمک کند.
دریافت مشاوره ژنتیک